 2SO3(g)。
2SO3(g)。 2SO3(g) ΔH=-197kJ·mol-1。现有甲、乙、丙三个相同的容积不变的容器,按下表中数据充入气体并反应达到平衡,放出或吸收的热量的数值分别为Q1、Q2、Q3。下列说法中不正确的是 。
2SO3(g) ΔH=-197kJ·mol-1。现有甲、乙、丙三个相同的容积不变的容器,按下表中数据充入气体并反应达到平衡,放出或吸收的热量的数值分别为Q1、Q2、Q3。下列说法中不正确的是 。容器 |
SO2(mol) |
O2(mol) |
SO3(mol) |
热量(kJ) |
甲 |
2 |
1 |
0 |
Q1 |
乙 |
1 |
|
0 |
Q2 |
丙 |
0 |
0 |
1 |
Q3 |
 2 < Q3 < 197kJ
2 < Q3 < 197kJ

 提高燃煤烟气中
提高燃煤烟气中 去除率的有 (填字母)。
去除率的有 (填字母)。在温度T下,c(OH-)=0.1 mol·L-1的Ba(OH)2的PH值为11。
(1)该温度下,100ml水中含有OH-约有_个。
(2)该温度下,在PH=8的Ba(OH)2溶液中加入PH=5的盐酸,欲使混合溶液pH=7,则Ba(OH)2溶液与所加盐酸的体积比为__ __
若有等体积的a:PH=1的盐酸,b:PH=1的硫酸,c:物质的量浓度为0.1 mol·L-1的醋酸(均用物质序号回答下列问题):
①欲均加水稀释到相同PH值,所加水的体积关系是:。
②分别加入足量的锌粉,产生氢气体积(相同温度和压强)大小关系是
③某学生用蒸馏水润湿的PH试纸测定PH值,误差最小的是
(用化学用语及必要的文字回答)
(1) 配制碳酸钾溶液要加少量的_____,原因是____。
(2)FeCl3溶液蒸干并灼烧得到的固体是___ __,原因是______。
(8分)有四种钠的化合物W、X、Y、Z,根据以下反应式判断W、X、Y、Z的化学式
(1) W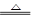 X + CO2↑ + H2O
X + CO2↑ + H2O
(2)Z + CO2→ X + O2↑
(3)Z + H2O→ Y + O2↑
(4)X +Ca(OH)2→ Y + CaCO3↓
则:W XYZ
有一固体粉末,其中可能含有Na2CO3、NaCl、Na2SO4、CuCl2、Ba(NO3)2、K2CO3、K2SO4中的一种或几种,现按下列步骤进行实验。
(1)将该粉末溶于水得无色溶液和白色沉淀。
(2)在滤出的沉淀中加入过量稀硝酸,有部分沉淀溶解,同时产生无色气体。
(3)取滤液做焰色反应,火焰呈黄色,透过蓝色的钴玻璃观察,未见紫色火焰。由上述现象推断:该混合物中一定有、、
;一定不含有、、;
可能含有。