已知热化学方程式:2SO2(g)+O2(g) 2SO3(g);ΔH=-Q kJ·mol-1,(Q>0)。下列说法正确的是
2SO3(g);ΔH=-Q kJ·mol-1,(Q>0)。下列说法正确的是
| A.相同条件下,2 mol SO2(g)和1 mol O2(g)所具有的能量小于2 mol SO3(g)所具有的能量 |
| B.将2 mol SO2(g)和1 mol O2(g)置于一密闭容器中充分反应后,放出热量为Q kJ |
| C.增大压强或升高温度,该平衡都向逆反应方向移动 |
| D.如将一定量SO2(g)和O2(g)置于某密闭容器中充分反应放热Q kJ,则此过程中有2 mol SO2(g)被氧化 |
在下列反应中,HNO3既表现出氧化性,又表现出酸性的是
A.H2S+2HNO3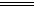 S↓+2NO2↑十2H2O S↓+2NO2↑十2H2O |
B.CuO+2HNO3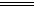 Cu(NO3)2十H2O Cu(NO3)2十H2O |
C.4HNO3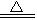 4NO2↑十O2↑十2H2O 4NO2↑十O2↑十2H2O |
D.3Cu+8HNO3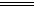 3Cu(NO3)2+2NO↑十4H2O 3Cu(NO3)2+2NO↑十4H2O |
在同温同压下,相同体积的烧瓶分别充满氨气和氯化氢气体,做喷泉实验后,水都充满烧瓶,烧瓶中溶液的物质的量浓度之比是
| A.1∶0.45 | B.1∶1 | C.1∶0.29 | D.4.5∶2.9 |
元素性质呈现周期性变化的根本原因是
| A.元素的相对原子质量递增,量变引起质变 |
| B.元素原子的核外电子排布呈周期性变化 |
C.元素 的原子半径呈周期性变化 的原子半径呈周期性变化 |
| D.元素的化合价呈周期性变化 |
已知气体的摩 尔质量越小,扩散速度越快。右图所示为气体扩散速度的试验,两种气体扩散相遇时形成白色烟环。下列关于物质甲、乙的
尔质量越小,扩散速度越快。右图所示为气体扩散速度的试验,两种气体扩散相遇时形成白色烟环。下列关于物质甲、乙的 判断正确的是
判断正确的是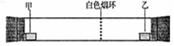
| A.甲是浓氨水,乙是浓硫酸 | B.甲是浓盐酸,乙是浓氨水 |
| C.甲是浓氨水,乙是浓盐酸 | D.甲是浓硝酸 ,乙是浓氨水 ,乙是浓氨水 |
已知:
① CH4 ( g )+4NO2( g )="4NO(" g ) +CO2( g )+2H2O( g ) △H=一574 kJ·mol-1
② CH4 ( g )+4NO( g )=2N2( g )+CO2( g )+2H2O( g ) △H=一1 160 kJ·mol一1。
下列正确的选项是
| A.CH4 ( g )+2NO2 ( g )= N2( g )+CO2 ( g )+2H2O ( l) △H=一867 kJ·mol-1 |
| B.CH4 ( g )+2NO2 ( g )= N2( g )+CO2 ( g )+2H2O ( g) △H=一867 kJ·mol-1 |
| C.CH4 ( g )+2NO2 ( g )= N2( g )+CO2 ( g )+2H2O ( g) △H=一586kJ·mol-1 |
| D.CH4 ( g )+2NO2 ( g )= N2( g )+CO2 ( g )+2H2O ( g) △H=+586kJ·mol-1 |