下图各容器中盛有海水,铁在其中被腐蚀时由快到慢的顺序是
| A.④>②>①>③ | B.④>②>③>① |
| C.②>①>③>④ | D.③>②>④>① |
向4.0 L容器中充入0.70 mol SO2和0.40 mol O2 , 4 s末测得剩余SO2 0.30 mol,则v(O2)为( )
| A.0.10 mol·L-1·s-1 | B.0.025 mol·L-1·s-1 |
| C.0.50 mol·L-1·s-1 | D.0.0125 mol·L-1·s-1 |
反应 A + 3B =" 2C" + 2D 在四种不同条件下的反应速率为:
(1)ひ
| A.=0.3mol/(L·s) (2)ひ | B.=0.6mol/(L·s)(3)ひ | C.="0.4mol/(L·s)" (4)ひ |
D.=0.45mol/(L·s),则该反应速率的快慢顺序为() |
A(2)>(4)>(3)>(1)B (2)>(3)=(4)>(1)
C (1) >(4)>(2)=(3) D (4)>(3)>(2)>(1)
镍—镉可充电电池可发生如下反应:Cd(OH)2+2Ni(OH)2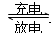 Cd+2NiO(OH)+2H2O,由此可知,该电池的负极材料是()
Cd+2NiO(OH)+2H2O,由此可知,该电池的负极材料是()
| A.Cd | B.NiO(OH) | C.Cd(OH)2 | D.Ni(OH)2 |
120℃时,将0.1 mol某气态烃在足量的氧气中完全燃烧,测得反应前后气体体积相等,则该气态烃可能()
| A.乙烷 | B.乙烯 | C.丙烷 | D.苯 |
一个电池反应的离子方程式是 Zn+Cu2+=Zn2+ +Cu,该反应的的原电池正确组合是()
| A |
B |
C |
D |
|
| 正极 |
Zn |
Cu |
Cu |
Fe |
| 负极 |
Cu |
Zn |
Zn |
Zn |
| 电解质溶液 |
CuCl2 |
H2SO4 |
CuSO4 |
HCl |