乙醇分子中各种化学键如下图所示,关于乙醇在各种反应中断裂键的说法不正确的是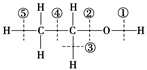
| A.和金属钠反应时键①断裂 |
| B.和浓H2SO4共热到170℃时键②和⑤断裂 |
| C.和浓H2SO4共热到140℃时仅有键②断裂 |
| D.在Ag催化下与O2反应时键①和③断裂 |
下列有关反应类型说法中正确的是()
A.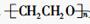 是通过加聚反应得到的产物 是通过加聚反应得到的产物 |
| B.乙醇在浓硫酸作催化剂,并且在加热的条件下一定发生消去反应 |
| C.卤代烃一般来说在NaOH的水溶液中能发生取代反应,而在NaOH的醇溶液中不一定能发生消去反应 |
| D.酯类物质在一定条件下水解一定得到相应的羧酸和醇 |
现有两种高聚物A、B,已知A能溶于氯仿等有机溶剂,并加热到一定条件下熔融成粘稠的液体,B不溶于任何溶剂,加热不会变软或熔融,则下列叙述中一定不正确的是()
A、高聚物A可能具有弹性,B可能没有弹性B、高聚物A可能是线型高分子材料
C、高聚物A一定是体型高分子材料 D、高聚物B可能是体型高分子材料
下列各组表述中,两个微粒一定不属于同种元素原子的是 ( )
| A.3p轨道有一个空轨道的基态原子和核外电子排布为1s22s22p63s23p2的原子 |
| B.M层全充满而N层为4s2的原子和核外电子排布为1s22s22p63s23p63d64s2的原子 |
| C.最外层电子数是核外电子总数1/5的原子和价电子排布为4s24p5的原子 |
| D.2p轨道有一个未成对电子的基态原子和原子的价电子排布为2s22p5的原子 |
下列说法正确的是()
| A.复合材料的使用使导弹的射程有了很大的提高,其主要原因在于复合材料的使用可以使导弹的质量减轻 |
| B.煤油可由石油干馏获得,可用作燃料和保存少量金属钠 |
| C.用溴水即可鉴别苯酚溶液、己烷和甲苯 |
| D.在酸性条件下,CH3CO18OC2H5的水解产物是CH3CO18OH和C2H5OH |
下列不属于合成纤维的是 ( )
| A.的确良 | B.棉花 | C.人造棉花 | D.氯纶 |