某同学用图示装置进行铁和稀硝酸反应的实验并进行相关的实验探究。
a.向广口瓶内注入足量热NaOH溶液,将盛有a g纯铁粉的小烧杯放入瓶中。
b.关闭止水夹,点燃红磷,伸入瓶中,塞好胶塞。
c.待红磷充分燃烧,一段时间后打开分液漏斗旋塞,向烧杯中滴入300mL 6mol/L的稀硝酸,铁粉恰好完全溶解。
(一)气体产物成分探究:
(1)燃烧红磷的目的是 。
(2)为证明气体产物为NO,步骤c后还缺少的一步主要操作是 。
(二)产物中铁元素价态探究:
(1)提出合理假设:
假设1:产物只有+3价铁;
假设2: ;
假设3: 。
(2)设计实验:分别取小烧杯中反应后溶液装入两支试管甲、乙,在甲试管中滴加酸性高锰酸钾溶液;在乙试管中滴加KSCN溶液,观察现象。推测实验现象与结论:
①若现象为: ,则假设1正确;
②若现象为: , 则假设2正确;
则假设2正确;
③若现象为: ,则假设3正确。
(3)a值范围为 。
已知化学反应①Fe(s)+CO2(g) FeO(s)+CO(g),其平衡常数为K1;化学反应②:Fe(s)+H2O(g)
FeO(s)+CO(g),其平衡常数为K1;化学反应②:Fe(s)+H2O(g) FeO(s)+H2(g),其平衡常数为K2。在温度973 K 和1173 K 情况下,K1、K2的值分别如下:
FeO(s)+H2(g),其平衡常数为K2。在温度973 K 和1173 K 情况下,K1、K2的值分别如下:
| 温度 |
K1 |
K2 |
| 973 K |
1.47 |
2.38 |
| 1173 K |
2.15 |
1.67 |
(1)通过表格中的数值可以推断:反应①是________(填“吸热”或“放热”)反应。
(2)现有反应③:CO2(g)+H2(g)  CO(g)+H2O(g),请你写出该反应的平衡常数K3的数学表达式:K3=________。
CO(g)+H2O(g),请你写出该反应的平衡常数K3的数学表达式:K3=________。
(3)能判断反应③已达平衡状态的是________。
A.容器中压强不变 B.混合气体中c(CO)不变 C.v正(H2)=v逆(H2O)D.c(CO2)=c(CO)
(4)根据反应①与②可推导出K1、K2与K3之间的关系式__________________。据此关系式及上表数据,也能推断出反应③是________(填“吸热”或“放热”)反应。要使反应③在一定条件下建立的平衡向正反应方向移动,可采取的措施是________(填写序号)。
A.缩小反应容器容积 B.扩大反应容器容积 C.降低温度
D.升高温度 E.使用合适的催化剂 F.设法减少CO的量
可逆反应:mA(g)+nB(g) pC(g)+qD(g),根据图回答:
pC(g)+qD(g),根据图回答: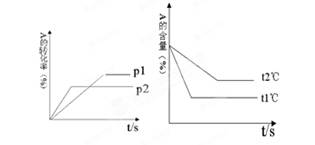
(1)压强P1比P2(填大或小);(2)(m +m)比(p +q)(填大或小);
(3)温度t1℃比t2℃(填高或低);(4)正反应为反应(填吸热或放热);
(5)一定温度下,该可逆反应的平衡常数表达式为:K=
某有机物A的化学式为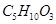 ,在浓硫酸存在和加热时,有如下性质:①A能与
,在浓硫酸存在和加热时,有如下性质:①A能与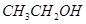 发生酯化反应,也能与
发生酯化反应,也能与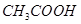 发生酯化反应;②A能消去脱水生成B,B是一种能使溴水褪色的物质;③A能分子内脱水,生成一种分子式为
发生酯化反应;②A能消去脱水生成B,B是一种能使溴水褪色的物质;③A能分子内脱水,生成一种分子式为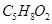 的六元环状酯类化合物。
的六元环状酯类化合物。
(1)请写出有机物A的结构简式。
(2)写出有机物A脱水生成B的化学方程式。
(3)写出③的化学方程式。
某有机物X(C12H13O6Br)遇到FeCl3溶液显紫色,其部分结构简式如下: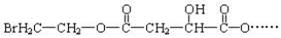
已知:X在足量的氢氧化钠水溶液中加热,可以得到A、B、C三种有机物。
(1)C中只有一种位置的氢原子。
(2)室温下A经盐酸酸化可以得到苹果酸E,E的结构简式为 ,
,
试回答:
(1)B中所含官能团的名称是_______。 (2)C的结构简式为_______。
(3)E不能发生的反应类型是_______(填序号)。
①加成反应 ②消去反应 ③氧化反应 ④酯化反应
(4)E的一种同分异构体F有如下特点:1molF可以和3mol金属钠发生反应,放出33.6LH2(标准状况下),1molF可以和足量NaHCO3溶液反应,生成1molCO2,1molF还可以发生银镜反应,生成2molAg。则F的结构简式可能是(只写一种)_______。
(5)在一定条件下两分子E可以生成六元环酯,写出此反应的化学方程式:
_______________________________________________________。
某有机物R完全燃烧产物只有CO2和H2O。已知1 mol R完全燃烧时,生成n molCO2,消耗1.5n molO2。试回答下列问题。
(1)若R为烃,则R的分子式为______________________。
(2)若R为烃的含氧衍生物,3.0 g R与足量金属钠反应生成560 mL(标准状况)H2,则R的分子式为 _____________________。