在给定的四种溶液中,加入以下各种离子,各离子能在原溶液中大量共存的有
| A.滴加石蕊试液显红色的溶液:Fe3+、NH4+、Cl-、I- |
| B.pH值为1的溶液:Cu2+、Na+ 、Mg2+、NO3- |
| C.水电离出来的c(H+)=10-13mol/L的溶液:K+、HCO3-、Br-、Ba2+ |
| D.所含溶质为Na2SO4的溶液:K+ 、CO32-、NO3-、Al3+ |
已知25℃时,Mg(OH)2的Ksp = 5.6×10-12,MgF2的Ksp = 7.4×10-11。下列说法正确的是
| A.25℃时,在Mg(OH)2的悬浊液中加入少量的NH4Cl固体,c(Mg2+)增大 |
| B.25℃时,饱和Mg(OH)2溶液与饱和MgF2溶液相比,前者c(Mg2+)大 |
| C.25℃时,Mg(OH)2固体在同体积同浓度的氨水和NH4Cl溶液中的Ksp 比较,前者小 |
| D.25℃时,在Mg(OH)2的悬浊液中加入饱和NaF溶液后,Mg(OH)2不可能转化成MgF2 |
下列有关Ksp的叙述中正确的是
| A.Ksp越大说明电解质的溶解度越大 |
| B.Ksp只与电解质的本性有关,而与外界条件无关 |
| C.Ksp表示难溶强电解质在水中达到沉淀溶解平衡时,溶液中离子浓度幂之积 |
| D.Ksp的数值只与难溶电解质的性质有关,和温度无关 |
欲使0.1mol/L的NaHCO3溶液中c(H+)、c(CO32-)、c(HCO3-)都减少,其方法是
| A.通入二氧化碳气体 | B.加入饱和石灰水溶液 |
| C.通入氯化氢气体 | D.加入氢氧化钠固体 |
醋酸溶液中存在电离平衡CH3COOH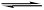 H++CH3COO-,下列叙述不正确的是
H++CH3COO-,下列叙述不正确的是
| A.醋酸溶液中离子浓度的关系满足:c(H+)=c(OH-)+c(CH3COO-) |
| B.0.10mol/L的CH3COOH溶液中加水稀释,溶液中c(OH-)减小 |
| C.CH3COOH溶液中加少量的CH3COONa固体,平衡逆向移动 |
| D.常温下pH=2的CH3COOH溶液与pH=12的NaOH溶液等体积混合后,溶液的pH<7 |
下列各项中的两个量,其比例2∶1的是
| A.硫酸铵固体中n(NH4+)与n(SO42—) |
| B.相同温度下,0.01 mol/L的醋酸溶液与0.02 mol/L 醋酸溶液中的c(H+) |
| C.液面均在“0”刻度时,50 mL酸式滴定管和25 mL酸式滴定管内所盛溶液的体积 |
| D.40℃时pH=7的(NH4)2SO4与NH3·H2O的混合液中,c(NH4+)与c(SO42—) |