课堂学习中,同学们利用镁条、锌片、铜片、导线、电流计、橙汁、烧杯等用品探究原电池的组成。下列结论错误的是
| A.原电池是将化学能转化成电能的装置 |
| B.原电池由电极、电解质溶液和导线等组成 |
| C.上图中a极为镁条、b极为锌片时,导线中会产生电流 |
| D.上图中a极为锌片、b极为铜片时,电子由铜片通过导线流向锌片 |
海洋中有丰富的食品、矿产、能源、药物和水产资源等(如下图所示),下列有关说法正确的是
| A.第①步中除去粗盐中的SO42-、Ca2+、Mg2+、Fe3+等杂质,加入的药品顺序可以为、NaOH溶液BaCl2溶液,碳酸钠溶液,过滤后加盐酸 |
| B.第②步中结晶出的MgCl2·6H2O可在蒸发皿中加热制无水MgCl2 |
| C.在第④步中的反应离子方程式为Br2+SO2+2H2O=2H+ +SO42-+2HBr |
| D.第⑤步涉及的分离操作有过滤、萃取、蒸馏 |
利用如图所示装置进行下列实验,能得出相应实验结论的是
| 选项 |
① |
② |
③ |
实验结论 |
| A |
浓盐酸 |
MnO2 |
NaBr溶液 |
氧化性Cl2>Br2 |
| B |
浓氨水 |
碱石灰 |
AgNO3溶液 |
AgOH具有两性 |
| C |
浓硫酸 |
Na2SO3 |
FeCl3溶液 |
SO2具有还原性 |
| D |
稀盐酸 |
Na2CO3 |
Na2SiO3溶液 |
非金属性Cl>C>Si |
在100 mL混合溶液中,HNO3和H2SO4的物质的量浓度分别为0.4mol/L和0.1 mol/L,向该混合液中加入1.92g铜,加热后,所得溶液中Cu2+的浓度是
| A.0.15mol/L | B.0.225 mol/L | C.0.35mol/L | D.0.45mol/L |
X、Y、Z、W是原子序数依次增大的短周期元素,且互不同族;其中只有两种为金属;X原子的最外层电子数与次外层电子数相等;X与W、Y与Z这两对原子的最外层电子数之和均为9。单质Y和W都可与浓的NaOH溶液反应。下列说法不正确的是
| A.离子半径: Z>W >Y | B.非金属性最强的元素为W |
| C.Y的最高价氧化物对应的水化物为两性 | D.XW2是离子化合物 |
下列实验装置、试剂选用或操作正确的是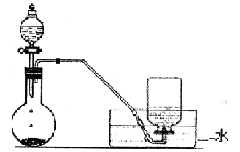
| A.稀释浓硫酸 | B.制备少量O2 |
| C.浓氨水和生石灰反应制取氨气 | D.除去NO中的NO2 |