(10分)钢铁工业是国家工业的基础。请回答钢铁腐蚀、防护过程中的有关问题。
(1)铁在潮湿的空气中容易被腐蚀为铁锈(Fe2O3•x H2O),写出铁发生电化学腐蚀时负极的电极反应:___________________________________。
(2)下列各个装置中铁棒被腐蚀由难到易的顺序是_______________(填字母)。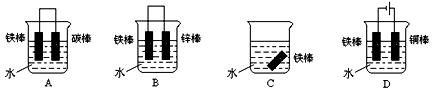
(3)在实际生产中,可在铁件的表面镀铜防止铁被腐蚀。装置如图,请回答:
① A电极的电极反应式是 __
②若电镀前铁、铜两电极的质量相同,电镀完成后, 若电镀时
电路中通过的电子为0.2mol,将它们取出洗净、烘干、称量,则A、B两极质量相差____g。
③镀层破损后,镀铜铁比镀锌铁更容易被腐蚀,请简要说明原因
。
下图为以惰性电极进行电解: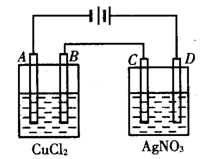
写出A、B、电极上的电极反应式和总反应式:
A:_________________________]B:__________________________,
总反应方程式:________________________;
在一定体积的密闭容器中,进行如下化学反应:
CO2(g)+H2(g)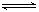 CO(g)+H2O(g),
CO(g)+H2O(g),
其化学平衡常数K和温度t的关系如下表:
| t/℃ |
700 |
800 |
830 |
1000 |
1200 |
| K |
0.6 |
0.9 |
1.0[ |
1.7 |
2.6 |
回答下列问题:
(1)该反应的化学平衡常数表达式为K=。
(2)该反应为反应(填“吸热”或“放热”)。
(3)能判断该反应是否达到化学平衡状态的依据是。
a.容器中压强不变 b.混合气体中 c(CO)不变
c.υ正(H2)= υ逆(H2O) d.c(CO2)= c(CO)
(4)某温度下,平衡浓度符合下式: c(CO2)·c(H2)= c(CO)·c(H2O),试判断此时的温度为℃。
已知:① N2 (g) + 3H2 (g)  2NH3 (g) ΔH=-92.4 kJ/mol
2NH3 (g) ΔH=-92.4 kJ/mol
② 2H2 (g)+ SO2 (g)  S (g) + 2H2O (g)ΔH =+90.4 kJ/mol
S (g) + 2H2O (g)ΔH =+90.4 kJ/mol
③ 2H2 (g) + CO (g)  CH3OH (g) ΔH=-90.8 kJ/mol
CH3OH (g) ΔH=-90.8 kJ/mol
请回答:
(1)上述变化过程中放出热量的是(填序号,下同),吸收热量的是。
(2)4 g H2 (g) 完全反应生成甲醇气体时,ΔH =kJ/mol。
(3)生成1 mol NH3 (g) 的放出的热量为kJ。
写出下列电解质的电离方程式:
CH3COOH
NaOH
NaHSO4
NaHCO3
铜和浓硫酸发生反应的化学方程式为:Cu +2H2SO4(浓)="=" CuSO4+SO2↑+2H2O,其中铜元素的化合价_______(填“升高”或“降低”),被_________(填“氧化”或“还原”,下同);浓H2SO4作_________剂,具有性。在该反应中,若消耗了1 mol Cu,则生成_______mol SO2。