工业合成氨反应:N2+3H2 2NH3,在一定条件下已达到平衡状态。
2NH3,在一定条件下已达到平衡状态。
(1)若降低温度,会使上述平衡向生成氨的方向移动,生成每摩尔氨的反应热数值是46.2KJ/mol,则该反应的热化学方程式为 。
(2)若在恒温条件下,将N2与H2按一定比例混合的气体通入一个容积为2升固定容积的密闭容器中,5分钟后反应达平衡时,n(N2)="1.2mol," n(H2)="1.2mol," n (NH3)=0.8mol,则反应速率V(N2)= mol·L-1·min-1,H2的转化率= ,平衡常数= 。若保持容器的温度和容积不变,将上述平衡体系中的混合气体的浓度增大1倍,则平衡 (填向左﹑向右或不移动)移动。
(3)若在恒温恒压条件下,将1 molN2与3 molH2的混合气体通入一个容积可变的容器中发生反应,达平衡后,生成a molNH3,这时N2的物质的量为 mol,(用含a的代数式表示);若开始时只通入N2与H2,达平衡时生成3amolNH3,则开始时应通入N2 3mol,H2 = mol(平衡时NH3的质量分数与前者相同);若开始时通入x molN2﹑6molH2和2mol NH3,达平衡后,N2和NH3的物质的量分别为y mol和3a mol,则x= mol,y= mol(用含a的代数式表示)
某固体混合物可能由Al、(NH4)2SO4、MgCl2、AlCl3、FeCl2中的一种或几种组成,现对该混合物作如下实验,所得现象和有关数据如图所示(气体体积数据已换算成标准状况下的体积):
回答下列问题:
⑴混合物中是否存在FeCl2___(填“是”或“否”);
⑵混合物中是否存在(NH4)2SO4___(填“是”或“否”),你的判断依据是
 。
。
⑶写出反应④的离子反应式: 。
。
⑷请根据计算结果判断混合物中是否含有Al Cl3(说出你的计算依据,不要求写计算过程)
Cl3(说出你的计算依据,不要求写计算过程)
。
⑸把AlCl3溶液中加热浓缩 蒸干,不能得到AlCl3晶体,请你设计一个可行的简易实验方案,怎样从溶液中得到较纯的AlCl3结晶?
蒸干,不能得到AlCl3晶体,请你设计一个可行的简易实验方案,怎样从溶液中得到较纯的AlCl3结晶?
。
由单质A和化合物B两种粉末组成的混合物,在一定条件下可按下页框图所示关系进行转化:
请回答:
(1) A、B的化学式分别是_____________________、_____________________。
(2) 写出反应①的化学反应方程式___________ __________。
__________。
(3)写出反应②、③的离子方程式②_________ ____________;
____________;
③___________________。
(4)若要保存F溶液,应采取什么措施?;
为什么? _____________________。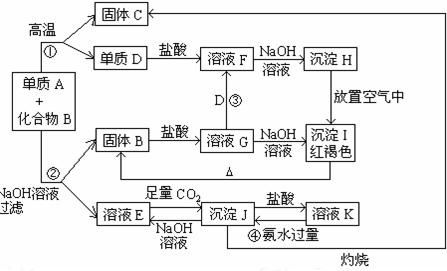
A、B、C、D、E、F六种短周期元素,原子序数依次增大。A、E同主族,且E元素原子的核外电子数是A元素原子核内质子数的两倍。B、C两元素原子的最外层电子数之和等于D元素原子的最外层电子数,C、D两元素原子最外层电子数之和等于F元素原子的最外层电子数。D元素原子最外层电子数是次外层电子数的一半。回答下列问题:
(1) 写出元素D基态原子的电子排布图:;
(2)用电子式表示B、F两元素形成化合物的过程:;
(3)A的气态氢化物的沸点(填“高于”、“低于”)E的气态氢化物的稳定性;原因是:。
在热的稀硫酸溶液中溶解了11.4 g FeSO4 ,当加入50 mL 0.5 mol / L KNO3溶液后,使其中的Fe2+全部转化成Fe3+,KNO3也反应完全,并有NxOy氮氧化物气体逸出。
(1)推算出x=_________,y= _________
(2)配平该化学方程式(化学计量数填写在上式方框内)
(1)用18mol·L-1的硫酸配制1.00 mol·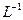 的硫酸100mL。若实验仪器有:
的硫酸100mL。若实验仪器有:
A.100mL量筒、B.托盘天平、C.玻璃棒、D.50mL容器瓶、E. 10mL量筒、
F.胶头滴管、G. 50mL烧杯、H. 100mL容量瓶。
实验时应选用仪器是(填 字母);
字母);
(2)在容量瓶的使用方法 中,下列操作不正确的是(填字母);
中,下列操作不正确的是(填字母);
A.使 用容量瓶前检查其是否漏水。
用容量瓶前检查其是否漏水。
B.容量瓶用蒸馏水洗净后,再用待配溶液洗涤。
C.配制溶液时,如果试样是固体,把称好的试样用纸条小心倒入容量瓶中,缓慢加入蒸馏水到接近刻度线1—2cm处,用胶头滴管滴加蒸馏水到刻度线。
D.配制溶液时,如果试样是液体,用量筒量取试样后直接倒入容量瓶中,缓慢加入蒸馏水到接近刻度线1—2cm处,用胶头滴管滴加蒸馏水到刻度线。
E.盖好瓶盖,用食指顶住瓶塞,用另一只手的手指托住瓶底,把容量瓶倒转和摇动多次
(3)浓H2SO4稀释时应该
;
(4)若实验遇到下列情况,对硫酸溶液的物质的量浓度有何影响?(填“偏高”、“偏低”或“不变”)
①稀释硫酸后的烧杯未洗涤:;
②未经冷却趁热将溶液注入容量瓶中:;
③摇匀后发现液面低于刻度线再加水:;
④容量瓶中原有少量蒸馏水:。