某溶液中,可能存在NH4+、Fe2+、Br-、CO32-、I-、SO32- 6种离子中的几种。①在原溶液中滴加足量氯水后,有气泡产生,溶液呈橙黄色;②向橙黄色溶液中加入BaCl2溶液时无沉淀生成;③橙黄色溶液不能使淀粉变蓝色。根据以上实验事实推断,该溶液中肯定不存在的离子为
| A.NH4+、Br-、CO32- | B.NH4+、SO32-、I- |
| C.Fe2+、I-、SO32- | D.Fe2+、CO32-、I- |
1909年丹麦科学家Sorensen用公式pH=-lgc(H+)引入pH,1999年荷兰科学家HenK Van Lubeck提出酸度(AG)的概念,以更好地表示溶液的酸碱性。酸度(AG)的定义为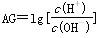 。下列有关叙述中错误的是( )
。下列有关叙述中错误的是( )
| A.常温时,中性溶液的pH=7,AG=0 |
| B.酸性溶液的AG>0,AG越大,溶液的pH越小 |
| C.碱性溶液的AG>0,AG越大,溶液的pH越大 |
| D.常温下,0.1 mol/LNaOH溶液,AG=-12,pH=13 |
两根金属铂做电极,以KOH溶液做电解质溶液,从两极分别通入CH4(g)和O2,则对该燃料电池的下列叙述中正确的是()
| A.负极的电极反应式为:CH4-8e-+10OH-=CO32-+7H2O |
| B.负极的电极反应式为:4OH--4e-=2H2O+O2↑ |
| C.标准状况下,通入5.6 LO2并完全反应后,有0.50mol电子转移 |
| D.放电一段时间后,通入O2的电极附近溶液的pH降低 |
下列四种溶液(1)pH=0的盐酸溶液(2)0.1mol/L的盐酸溶液(3)0.01mol/L的NaOH(4)pH=11的NaOH溶液由水电离出的c(H+)浓度之比( )
| A.1:10:100: 1000 | B.0:1:11:11 |
| C.14:13:12:11 | D.100;10:1:0 |
若溶液中由水电离产生的c(OH-)=1×10-14 mol/L,则此溶液中一定可以大量共存的离子组是()
| A.Al3+、Na+、NO3-、Cl- | B.K+、Na+、Cl-、NO3- |
| C.K+、Na+、Cl-、AlO2- | D.K+、NH4+、SO42-、NO3- |
已知次氯酸是比碳酸还弱的酸,反应Cl2+H2O HCl+HClO达到平衡后,要使HClO浓度增大,可加入()
HCl+HClO达到平衡后,要使HClO浓度增大,可加入()
| A.Na2SO3固体 | B.水 | C.CaCO3固体 | D.NaOH固体 |