北京市场销售的某种食用精制盐包装袋上有如下说明:
| 产品标准 |
GB54 61 61 |
| 产品等级 |
一级 |
| 配 料 |
食盐、碘酸钾、抗结剂 |
| 碘含量(以I计) |
20~50mg/kg |
| 分装时期 |
|
| 分装企业 |
|
(1)碘酸钾与碘化钾在酸性条件下发生如下反应,配平化学方程式(将化学计量数填于空白处)
KIO3+ KI+ H2SO4= K2SO4+ I2+ H2O
(2)上述反应生成的I2可用四氯化碳检验。向碘的四氯化碳溶液中加入Na2SO3稀溶液,将I2还原,以回收四氯化碳。
①Na2SO3稀溶液与I2反应的离子方 程式是 。
程式是 。
② 某学生设计回收四氯化碳的操作步骤为:
某学生设计回收四氯化碳的操作步骤为:
a.将碘的四氯化碳溶液置于分液漏斗中;
b.加入适量Na2SO3稀溶液;
c.分离出下层液体。
以上设计中遗漏的操作及在上述步骤中的位置是 。
(3)已知:I2+2S2O32-=2I-+S4O62-。某学生测定食用精制盐的碘含量,其步骤为:
a. 准确称取Wg食盐,加适量蒸馏水使其完全溶解;
b.用稀硫酸酸化所得溶液,加入足量KI溶液,使KIO3与KI反应完全;
c.以淀粉为指示剂,逐滴加入物质的量浓度为2.0×10-3mol·L-1的Na2S2O3溶液10.0mL,恰好反应完全。
①判断c中反应恰好完全依据的现象是 。
②b中反应所产生的I2的物质的量是 mol。
③根据以上实验和包装袋说明,所测精制盐的碘含量是 mg/kg。(以含w的代数式表示)
用18 mol/L的浓硫酸配制100 mL 1mol/L硫酸。
(1)量取浓硫酸的体积应为mL,用量筒量取浓硫酸缓缓倒入盛水的烧杯中后,( 填“应该”或“不应”)用少量蒸馏水洗涤量筒2~3次并将洗涤溶液也倒入烧杯中。
填“应该”或“不应”)用少量蒸馏水洗涤量筒2~3次并将洗涤溶液也倒入烧杯中。
(2)若实验仪器有:A.100 mL量筒 B.托盘天平 C. 玻璃棒 D. 50 mL容量瓶 E. 10 mL量筒 F. 胶头滴管 G. 50 mL烧杯 H. 100 mL容量瓶
实验时应选用的仪器有(填入编号)。
(3)定容时,若俯视液面,则所配溶液浓度( 填“偏高”、“偏低”或“无影响”)。若不小心加水超过了容量瓶刻度线,应(填入编号)。
填“偏高”、“偏低”或“无影响”)。若不小心加水超过了容量瓶刻度线,应(填入编号)。
A.用胶头滴管将多余溶液吸 出 B.加热容量瓶使水挥发 C.重新配制
出 B.加热容量瓶使水挥发 C.重新配制
(14分)过碳酸钠(Na2CO4)和稀硫酸反应的化学方程式为:2Na2CO4+2H2SO4=2Na2SO4+2CO2↑+O2↑+2H2O 某过碳酸钠样品中含有少量过氧化钠,甲、乙两位同学各称取质量
某过碳酸钠样品中含有少量过氧化钠,甲、乙两位同学各称取质量 为m的该样品,并用下图所示是仪器测定样品的纯度。仪器的连接顺序是:甲是①⑦③⑥④;乙是①②。请回答下列问题:
为m的该样品,并用下图所示是仪器测定样品的纯度。仪器的连接顺序是:甲是①⑦③⑥④;乙是①②。请回答下列问题: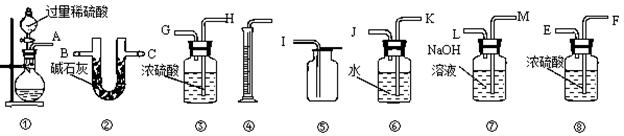
(1)甲同学想通过实验测得的数据是。他使用之中③______(填“有”或“没有”)必要。
(2) 乙同学想通过实验测得的数据是 。按他测得的数据计算出的实验结果_______(填“偏高”或“偏低”),理由是。
。按他测得的数据计算出的实验结果_______(填“偏高”或“偏低”),理由是。
(3). 为了测得准确的实验数据,请你将乙同学的实验装置进行改进(每种仪器只准使用一次),写出各仪器接的连接顺序。
(4). 按你设计的实验装置进行实验,若测得实验前后装置②的质量分别是w1和w2,则样品中过碳酸钠的质量分数为。
某强碱性溶液中可能含有的离子是K+、NH4+、Al3+、HCO3-、AlO2-、SO42-、CO32-、Cl-中的某几种离子,现进行如下实验:
①取少量的溶液用硝酸酸化后,加Ba(NO3)2溶液,无沉淀生成.
②另取少量溶液逐滴加入盐酸,其现象是:一段时间保持原样后,开始产生沉淀并逐渐增多,沉淀量基本不变后产生一种气体,最后沉淀逐渐减少至消失。
(1)原溶液中肯定存在的离子是,肯定不存在的 离子是,不能确定的离子是,其检验方法是
离子是,不能确定的离子是,其检验方法是
。
(2)按照反应顺序逐步书写出②中发生反应的离子反应方程式①H++OH-=H2O
②。
③。
④HCO3-+H+=H2O+CO2↑
⑤。
铁矿石是工业炼铁的主要原料之一,其主要成分为铁的氧化物(设杂质中不含铁元素和氧元素,且杂质不与H2SO4反应)。某研究性学习小组对某铁矿石中铁的氧化物的化学式进行探究。
Ⅰ.铁矿石中含氧量的测定
① 按上图组装仪器,检查装置的气密性;
② 将5.0g铁矿石放入硬质玻璃管中,装置B、C中的药品如图所示(夹持仪器均省略);
③ 从左端导气管口处不断地缓缓通入H2,待C装置出口处H2验纯后,点燃A处酒精灯;
④ 充分反应后,撤掉酒精灯,再持续通入氢气至完全冷却。
(1)装置C的作用为。
(2)测的反应后装置B增重1.35g,则铁矿石中氧的质量百分含量为。
(3)若将H2换成CO,则还需补充装置。
(1)步骤④中煮沸的作用是。
(2)下列有关步骤⑥的操作中说法正确的是。
a.因为碘水为黄色,所以滴定过程中不需加指示剂
b.滴定过程中可利用淀粉溶液作为指示剂
c.滴定管用蒸馏水洗涤后可以直接装液
d.锥形瓶不需要用待测夜润洗
e.滴定过程中,眼睛注视滴定管中液面变化
f.滴定结束后,30s内溶液不恢复原来的颜色,再读数
(3)若滴定过程中消耗0.5000mol·L−1的KI溶液20.00mL,则铁矿石中铁的质量百分含量为 。
。
Ⅲ.由Ⅰ、Ⅱ可以推算出该铁矿石中铁的氧化物的化学式为。
50mL 0.50mol/L盐酸与50mL 0.55mol/L NaOH溶液进行中和反应,通过测定反应过程中所放出的热量可计算中和热。
回答下列问题:
(1)从实验装置上看,图中尚缺少的一种玻璃用品是。
(2)烧杯间填满碎纸条的作用是。
(3)大烧杯如不盖硬纸板,测得的中和热数值(填“偏大 ”、“偏小”或“无影响”)
”、“偏小”或“无影响”)
(4)实验中改用60mL 0.50mol/L盐酸跟50mL0.55mol/LNaOH溶液进行反应,与上述实验相比,所放出的热量(填“相等”或“不相等”),所求中和热 (填“相等”或“不相等”),简述理由。
(填“相等”或“不相等”),简述理由。
(5)用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得中和热的数值会(填“偏大”、“偏小”或“无影响”);用50mL 0.50mol/L NaOH溶液进行上述实验,测得的中和热的数值会(填“偏大”、“偏小”或“无影响”)。