X、Y、Z都是第三周期元素,核电荷数依次增大,X的氧化物对应水化物为强碱,Z的原子半径在同周期最小。据此判断下列说法不正确的是
A.X是 第IA元素,Z是第ⅦA元素 第IA元素,Z是第ⅦA元素 |
| B.X、Y、Z三种元素的最高化合价依次升高 |
| C.如果Y的最高价氧化物的水化物难溶于水,则Y一定是Al |
| D.Z的最高价氧化物对应的水化物是强酸 |
下列各组有机物只用一种试剂无法鉴别的是
| A.乙醇、甲苯、硝基苯 | B.苯、苯酚、己烯 |
| C.苯、甲苯、环己烷 | D.甲酸、乙醛、乙酸 |
下列有机物在酸性催化条件下发生水解反应,生成两种不同的有机物,且这两种有机物的相对分子质量相等,该有机物是
| A.蔗糖 | B.葡萄糖 | C.丙酸丙酯 | D.戊酸丁酯 |
下列各组离子在溶液中能大量共存,并且加入过量NaOH溶液得到澄清溶液的是
| A.Fe3+.Na+.I-.SO42- | B.Al3+.Na+.Cl-.NO3- |
| C.Ag+.Na+.Cl-.NO3- | D.K+.Al3+.AlO2-.CO32- |
下列叙述正确的是
| A.电镀时应把镀件置于电解槽的阳极 |
| B.电解稀氢氧化钠溶液,要消耗OH-,故溶液pH减小 |
| C.目前已经研制成功铝—空气电池,铝为电池的负极 |
| D.原电池的负极和电解池的阳极所发生的反应同属还原反应 |
下列有关物质结构的表述正确的是
A.次氯酸的电子式: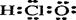 |
B.二氧化硅的分子式:SiO2 |
C.二氧化碳的比例模型: |
D.Cl-的结构示意图: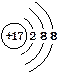 |