下列实验原理、装置、试剂选用、结论正确的是
| A.用湿润的pH试纸测定稀盐酸的pH |
| B.用下图1构成锌—铜原电池 |
| C.用下图2根据有关实验现象推知酸性:CH3COOH>H2CO3>C6H5OH |
| D.用下图3验证溴乙烷发生消去反应生成烯烃 |
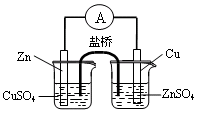
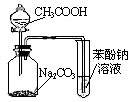
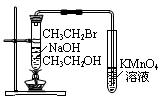
图1 图2 图3
下列离子方程式书写正确的是
| A.向水中通入氯气:Cl2+H2O=2H++ClO-+Cl- |
| B.向Ca(HCO3)2溶液中滴加足量NaOH溶液:Ca2++2HCO3-+2OH-=CaCO3↓+CO32-+2H2O |
| C.向明矾溶液中加过量氨水:Al3++4NH3·H2O=AlO2-+4NH4++2H2O |
| D.将Fe2O3溶解与足量HI溶液:Fe2O3+6H+= 2Fe3++3H2O |
下列叙述不正确的是
| A.甲烷、苯、乙醇、乙酸和酯类都可以发生取代反应 |
| B.蛋白质溶液中加入浓的硫酸铵溶液会有蛋白质析出 |
| C.纤维素和淀粉的通式都是(C6H10O5)n,它们之间互为同分异构体 |
| D.可用溴的四氯化碳溶液区分直馏汽油和裂化汽油 |
右图是一种航天器能量储存系统原理示意图。下列说法正确的是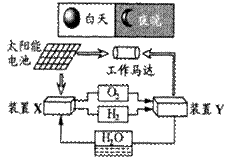
| A.白天该系统中存在电能向化学能的转化 |
B.装置Y中负极的电极反应式为: |
| C.装置X能实现燃料电池的燃料和氧化剂再生 |
| D.装置的X的阳极生成的产物是H2 |
下列装置所示的实验中,能达到实验目的的是
航天技术上使用一种氢氧燃料电池,它具有高能轻便、不污染环境等优点,该电池总反应方程式为:2H2+O2=2H2O,该电池的正极反应可表示为
| A.O2+4H++4e-=2H2O | B.2H2-4e-=4H+ |
| C.4OH--4e-=O2↑+2H2O | D.O2+2H2O+4e-=4OH- |