下列叙述正确的是
| A.pH=5的CH3COOH溶液和pH=5的NH4Cl溶液中,水的电离程度相同 |
B.2SO2(g) + O2(g) 2SO3(g)的正、逆反应的平衡常数K随温度的变化可用右图表示 2SO3(g)的正、逆反应的平衡常数K随温度的变化可用右图表示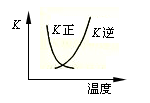 |
C.2NO+2CO 2CO2+N2的△H<0,则该反应一定能自发进行 2CO2+N2的△H<0,则该反应一定能自发进行 |
| D.25°C时,在Mg(OH)2的悬浊液中加入少量的NH4Cl固体c(Mg2+)增大 |
右图表示在密闭容器中C(s)+H2O(g) CO(g)+H2O(g)(正反应吸热),反应达到平衡后,由于条件的改变而引起正、逆反应速率的变化,以及平衡移动的状况,据图可知,改变的条件是( )
CO(g)+H2O(g)(正反应吸热),反应达到平衡后,由于条件的改变而引起正、逆反应速率的变化,以及平衡移动的状况,据图可知,改变的条件是( )
| A.增加CO浓度 | B.升高温度 | C.增大压强 | D.增加水蒸气 |
在高温下,反应2HBr(g) H2(g)+Br2(g)(正反应为吸热反应)达到平衡时,要使混合物气体的颜色加深,可采用的反应条件是( )
H2(g)+Br2(g)(正反应为吸热反应)达到平衡时,要使混合物气体的颜色加深,可采用的反应条件是( )
| A.减小压强 | B.缩小体积 |
| C.升高温度 | D.增大氢气的浓度 |
已知下列化学反应:
3A(g)+B(g) C(s)+4D(g);正反应放热图中a、b分别表示在一定条件下,D的体积分数〔φ(D)〕随反应时间t的变化情况。若使曲线b变为曲线a,可采取的措施是( )
C(s)+4D(g);正反应放热图中a、b分别表示在一定条件下,D的体积分数〔φ(D)〕随反应时间t的变化情况。若使曲线b变为曲线a,可采取的措施是( )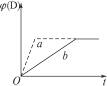
A.增大B的浓度B.降低反应温度
C.缩小容器体积 D.加入催化剂
在一定条件下,发生CO+NO2 CO2+NO的反应,达到化学平衡后,降低温度,混合物的颜色变浅。下列关于该反应的说法正确的是( )
CO2+NO的反应,达到化学平衡后,降低温度,混合物的颜色变浅。下列关于该反应的说法正确的是( )
| A.该反应为吸热反应 | B.该反应为放热反应 |
| C.降温后一氧化碳的浓度增大 | D.降温后各物质的浓度不变 |
对于可逆反应aA(g)+bB(g) cC(g)+dD(g),达平衡后,改变某条件时,发生右图所示的变化,下列选项叙述正确的是( )
cC(g)+dD(g),达平衡后,改变某条件时,发生右图所示的变化,下列选项叙述正确的是( )
| A.a+b<c+d,减压 | B.a+b>c+d,加压 |
| C.a+b<c+d,加压 | D.a+b>c+d,减压 |