某有机化合物结构如下,分析其结构并完成下列问题: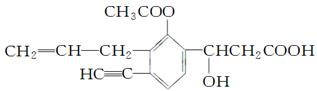
(1)写出其分子式__________。
(2)其中含有________个不饱和碳原子,分子中有________种双键
(3)一定与苯环处于同一平面的碳原子有________个,分子中C≡C—H键角为________。
(15分)氨基磺酸(H2NSO3H)是一元固体强酸,溶于水和液氨,不溶于乙醇,在工业上用作酸性清洗剂、阻燃剂、磺化剂等。市售商品为白色粉末,在常温下,只要保持干燥不与水接触,固体的氨基磺酸不吸湿,比较稳定。它具有不挥发、无臭味和对人体毒性极小的特点。某实验组用尿素和发烟硫酸(溶有SO3的硫酸)为原料合成氨基磺酸的路线如下 “磺化”步骤中所发生的反应为:
①CO(NH2)2(s) + SO3(g)  H2NCONHSO3H(s)△H<0
H2NCONHSO3H(s)△H<0
②H2NCONHSO3H + H2SO4 2H2NSO3H + CO2↑
2H2NSO3H + CO2↑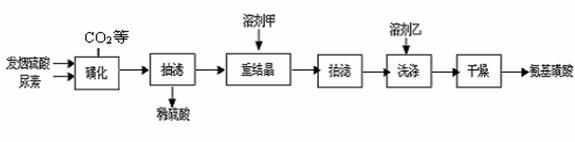
(1)下图是“磺化”过程的实验装置,恒压滴液漏斗的作用是 ____________
(2)抽滤时,所得晶体要用溶剂乙醇洗涤,则洗涤的具体操作是
(3)实验过程的讨论分析:
①重结晶时用溶剂甲(10%~12%的硫酸)作重结晶的溶剂用而不用水作溶剂的原因是
② “磺化”过程温度与产率的关系如图(1),控制反应温度为75~80℃为宜,若温度高于80℃,氨基磺酸的产率会降低,原因是。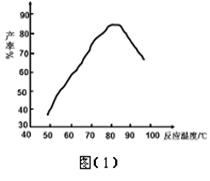
(4)测定产品中氨基磺酸纯度的方法如下:称取7.920g产品配成l000mL待测液,量取25.00mL待测液于锥形瓶中,加入2mL 0.2000mol·L-1稀盐酸,用淀粉碘化钾试剂作指示剂,逐滴加入0.08000mol·L-1NaNO2溶液,当溶液恰好变蓝时,消耗NaNO2溶液25.00mL,此时氨基磺酸恰好被完全氧化成N2,NaNO2的还原产物也为N2。
①以酚酞为指示剂,用NaOH进行酸碱中和滴定也能测定产品中氨基磺酸的纯度,测定结果通常比NaNO2法偏高,原因是氨基磺酸中混有 _____杂质。
②写出NaNO2滴定法中的化学方程式为:。
③试求产品中氨基磺酸的质量分数__________________________。
某研究小组对一元有机弱酸HA在溶剂苯和水的混合体系中溶解程度进行研究。在25℃时,弱酸HA在水中部分电离,HA的电离度为0.10;在苯中部分发生双聚,生成(HA)2。该平衡体系中,一元有机弱酸HA在溶剂苯(B)和水(W)中的分配系数为K,K=C(HA)B/C(HA)W=1.0,即达到平衡后,以分子形式存在的HA在苯和水两种溶剂中的比例为1∶1;已知:lg2=0.3,lg3=0.5其他信息如下:
| 25℃平衡体系(苯、水、HA) |
平衡常数 |
焓变 |
起始总浓度 |
| 在水中,HA=== H++A- |
K1 |
△H1 |
3.0×10-3 mol·L-1 |
| 在苯中,2HA== (HA)2 |
K2 |
△H2 |
4.0×10-3 mol·L-1 |
回答下列问题:
(1)计算25℃时水溶液中HA的电离平衡常数K1= 。
(2)25℃,该水溶液的pH为,在苯体系中HA的转化率为__________。
(3)25℃混合体系中,HA在苯中发生二聚,若测得某时刻溶液中微粒浓度满足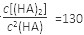 ,则反应向_______方向进行。
,则反应向_______方向进行。
(4)在苯中,HA自发进行发生二聚:2HA (HA)2,已知该二聚反应的反应热数值约为活化能的5/9 。下列能量关系图最合理的是。
(HA)2,已知该二聚反应的反应热数值约为活化能的5/9 。下列能量关系图最合理的是。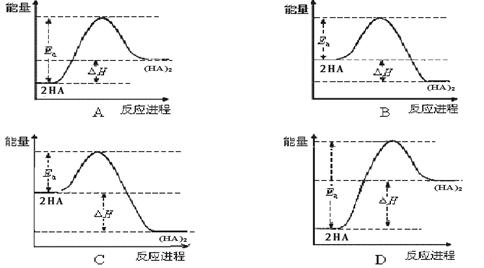
(5)下列有关该混合体系说法不正确的是。
A.用分液漏斗分离得到水溶液和苯溶液,若水溶液中加入少量水,苯溶液中加少量苯,则上述平衡均正移,且c(HA)均减小。
B.升高温度,HA的电离平衡常数K1和2HA (HA)2的平衡常数K2均变大。
(HA)2的平衡常数K2均变大。
C.若用酸碱中和滴定的分析方法,可以测出HA的起始总浓度。
D.在25℃时,若再加入一定量的HA固体,则水和苯中HA的起始总浓度之比仍为3:4。
(6)在25℃时,用0.1000mol/L氢氧化钠溶液滴定20.00mL 0.1000mol/L HA水溶液,请在下图中画出滴定曲线示意图。
已知A、B、C、D、E为中学化学常见的五种物质,均含元素R,R在A、B、C、D、E中所呈化合价依次递增,其中只有B为单质。常温下,A、B、C、D为气体,且D+H2O→C+E。
请回答下列问题:
⑴元素R在元素周期表中的位置为_____________; B分子的电子式为__________。
⑵已知气体D与NaOH溶液1:1恰好完全反应,生成R的两种含氧酸盐,所得溶液中各离子浓度大小关系。
⑶将22.4L某R的氧化物与足量的灼热铜粉完全反应后,气体体积变为11.2L(体积均在相同条件下测定),则该氧化物的化学式可能为。(填序号)
①、RO2 ②、R2O3③、RO④、R2O
⑷科学家制备的另一种化合物,与A的组成元素相同,具有很高的热值,可用作火箭和燃料电池的燃料。该化合物可由次氯酸钠溶液和A反应得到,写出该反应的化学方程式。
⑸M为E的钠盐,一定条件下可发生如下反应: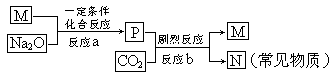
①设计实验方案,鉴定常见物质N。
②此外,科学家还制备了另一种钠盐X,其与P的组成元素完全相同,X中的阴离子与P中的阴离子表观形式相同(元素种类和原子个数均相同),但X中阴离子的结构中含有一个过氧键:-O-O- ,电导实验表明,同条件下其电导能力与NaCl相同,钠盐X的阴离子与水反应生成过氧化氢的离子方程式为。
| 25℃平衡体系(苯、水、HA) |
平衡常数 |
焓变 |
起始总浓度 |
在水中,HA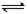 H++A- H++A- |
K1 |
△H1 |
3.0×10-3 mol·L-1 |
在苯中,2HA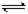 (HA)2 (HA)2 |
K2 |
△H2 |
4.0×10-3 mol·L-1 |
(本题共12分)
A是石油化学工业最重要的基础原料,以A为有机原料,无机试剂任选,按下列途径合成一种常见的医用胶(结构简式为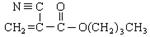 )
)
已知两个醛分子在一定条件下可以发生如下反应;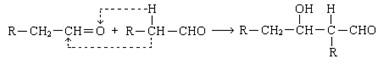
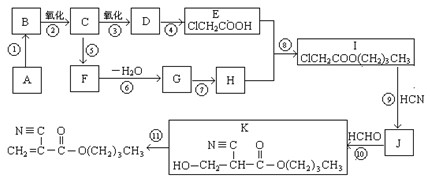
根据题意回答:
1.A的结构简式是_________________,D的官能团名称是。
2.⑥的反应条件是,I→J的另一生成物是。
3.属于取代反应的有(填反应序号)____________,⑩的反应类型是。
4.写出⑤的化学方程式:_____________________________________________________。
5.F有多种同分异构体,其中能够在NaOH溶液中发生反应的同分异构体有种。
6.如果以F为原料经过三步合成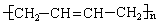 ,对应的反应类型分别为
,对应的反应类型分别为
。
(本题共8分)
已知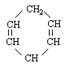 可简写为
可简写为 。现有某化合物W的分子结构可表示为
。现有某化合物W的分子结构可表示为 。根据题意回答:
。根据题意回答:
1.W属于
A.芳香烃 B.环烃 C.不饱和烃 D.炔烃
2.W的分子式为,它的一氯代物有种。
3.有关W的说法错误的是
A.能发生还原反应 B.能发生氧化反应
C.易溶于水 D.等质量的W与苯分别完全燃烧,前者消耗的氧气多
4.W有一种芳香族的同分异构体,该物质能在一定条件下发生聚合反应,相应的化学方程式为。