中科大陈乾旺教授等人发现了人工合成金刚石的新方法,其化学原理为:
(1)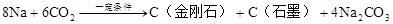
该法比1955年人工首次制得金刚石的方法容易得多,其化学原理是:
(2)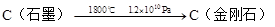
以下有关表述中正确的是( )
| A.新法(1)利用的是化学变化,旧法(2)利用的是物理变化 |
| B.在反应(1)中,利用了金属钠的还原性 |
| C.在反应(1)中每生成12g金刚石需要消耗23g金属钠 |
| D.在反应(1)和(2)中,金刚石都是还原产物 |
下列关于有机化合物的说法正确的是
| A.乙酸和乙酸乙酯可用Na2CO3溶液加以区别 | B.戊烷(C5H12)有两种同分异构体 |
| C.乙烯、聚氯乙烯和苯分子中均含有碳碳双键 | D.糖类、油脂和蛋白质均可发生水解反应 |
下列关于有机物的叙述正确的是
| A.乙醇不能发生取代反应 | B.C4H10有三种同分异构体 |
| C.氨基酸、淀粉均属于高分子化合物 | D.乙烯和甲烷可用溴的四氯化碳溶液鉴别 |
短周期元素X、Y、Z、W在元素周期表中的位置如下图所示,若W原子最外层电子数是其内层电子总数的3/5。下列说法中,正确的是
| A.X只有一种氧化物 |
| B.气态氢化物的稳定性Z>W |
| C.原子半径由大到小排列顺序Z>Y>X |
| D.元素X是自然界中形成化合物种类最多的元素 |
面粉厂必须严禁烟火的主要原因是
| A.防止火灾发生 |
| B.防止污染面粉 |
| C.吸烟有害健康 |
| D.面粉颗粒极小,当其扩散在空气中与空气充分接触,一旦引发反应,极易发生爆炸 |
工业生产硫酸过程中的一步反应是2 SO2 (g) + O2 (g)  2 SO3(g)。如果该反应在密闭容器内进行,能说明该反应达到化学平衡状态的是
2 SO3(g)。如果该反应在密闭容器内进行,能说明该反应达到化学平衡状态的是
| A.SO2 完全转化为SO3 |
| B.消耗2 mol SO2的同时生成2 mol SO3 |
| C.SO2、O2与SO3 的物质的量之比为2∶1∶2 |
| D.SO2、O2与SO3的浓度不再随时间变化 |