实验室中所用少量氯气用下列方法制取:4HCl(浓)+MnO2 Cl2↑+MnCl2+2H2O试回答下列问题:
Cl2↑+MnCl2+2H2O试回答下列问题: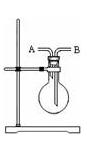
(1)该反应中 是氧化剂,氧化剂和还原剂的物质的量之比为 。写出该反应的离子方程式 。
(2)若用右图装置收集氯气,气体应从 口进入。
(3)氯气有毒、且氯气溶入水显酸性,请写出氯气溶于水的离子方程式
,若吸入大量氯气,可中毒死亡,所以氯气尾气直接排入大气中,会污染环境。实验室中可采用NaOH溶液来吸收有毒的氯气,化学方程式为 。
(本题7个空,每空2分,共14分)
(1)9.5g MgCl2溶于水配成100mL溶液,所得溶液的物质的量浓度为,取溶液25.0mL,稀释到500mL,此时溶液中Cl-的物质的量浓度为,在这两个实验中除了用烧杯、量筒、胶头滴管外,还需用到的玻璃仪器是。
(2)在反应3Cl2 + 6KOH(浓) ="=" 5KCl + KClO3 + 3H2O中,氧化产物与还原产物的物质的量之比为,3molCl2参加该反应时,反应中转移mol电子。
(3)氧化还原反应中实际上包含氧化和还原两个过程。下面是一个还原过程的反应式:NO3- +4H++3e- = NO↑+2H2O。KMnO4、Na2CO3、Cu2O、Fe2(SO4)3四种物质中的一种物质(甲)能使上述还原过程发生。
①写出该氧化还原反应的化学方程式(不需要配平):。
②反应中硝酸体现了的性质。
(本题9个空,每空2分,共18分)
Ⅰ、碳元素是日常生活中接触非常多的一种元素,回答下列问题。
(1)用化学方程式表示溶洞生成的反应原理:。
(2)可用稀盐酸来鉴别Na2CO3和NaHCO3溶液,现将稀盐酸慢慢滴入碳酸钠溶液中,请写出开始阶段发生反应的离子方程式。
(3)写出用小苏打来治疗胃酸过多时发生反应的离子方程式:。
Ⅱ、氮元素在生命活动中扮演着重要的角色,回答下列与氮及其化合物有关的问题:
(1)德国化学家哈伯、波施等科学家成功地开发了将氮气转化为氨气的生产工艺。请用化学方程式表示工业合成氨的反应原理:。写出在氨气的出气口处,检验有氨气生成的操作:。
(2)将氨气通入酚酞溶液中,酚酞溶液变成红色。请用方程式解释原因式:。
Ⅲ、印刷电路板是由塑料和铜箔复合而成,刻制印刷电路时要用FeCl3溶液作为“腐蚀液”溶解铜。
(1)写出该反应的离子方程式:;
(2)从使用过的腐蚀液中可以回收金属铜,下列试剂能实现的是(填序号)
| A.氯气 | B.铁 | C.硝酸 | D.稀硫酸 |
(3)向使用过的腐蚀液中通入Cl2,可使Fe2+转化为Fe3+,写出反应的离子方程式。
(16分)现有浓度均为0.1 mol·L-1的下列溶液:①硫酸 ②醋酸 ③氢氧化钠 ④氯化铵 请回答下列问题:
(1)四种溶液中由水电离出的H+浓度由大到小的顺序是(填序号)________________________。
(2)将③和④等体积混合后,混合液中各离子浓度由大到小的顺序是__________________________。
(3)已知T ℃,KW=1×10-13,则T ℃________25 ℃(填“>”、“<”或“=”)。在T ℃时将pH=11的NaOH溶液a L与pH=1的硫酸b L混合(忽略混合后溶液体积的变化),若所得混合溶液的pH=10,则a∶b=________。
(4)25 ℃时,有pH=x的盐酸和pH=y的氢氧化钠溶液(x≤6,y≥8),取a L该盐酸与b L该氢氧化钠溶液反应,恰好完全中和,求:
①若x+y=14,则a/b=________(填数据);
②若x+y=13,则a/b=________(填数据);
③若x+y>14,则a/b=________(填表达式);
④该盐酸与该氢氧化钠溶液完全中和,两溶液的pH(x、y)的关系式为________(填表达式)。
(10分)研究和开发CO2和CO的创新利用是环境保护和资源利用双赢的课题。
(1)CO可用于合成甲醇。在体积可变的密闭容器中充入4molCO和8molH2,在催化剂作用下合成甲醇:CO(g)+2H2(g) CH3OH(g)(Ⅰ),平衡时CO的转化率与温度.压强的关系如图所示:
CH3OH(g)(Ⅰ),平衡时CO的转化率与温度.压强的关系如图所示:
①该反应属于________反应;(填“吸热”或“放热”)
②在0.1Mpa .100℃的条件下,该反应达到平衡时容器体积为开始容器体积的_________倍。(结果保留两位小数点)
③在温度和容积不变的情况下,再向平衡体系中充入4molCO,达到平衡时CO转化率_______(填“增大”, “不变”或“减小”), 平衡常数K_______(填“增大”,“不变”或“减小”)。
(2)在反应(Ⅰ)中需要用到H2做反应物,以甲烷为原料制取氢气是工业上常用的制氢方法。已知:
①CH4(g)+ H2O(g)= CO(g)+3H2(g) △H="+206.2" kJ·mol-1
②CH4(g)+ CO2(g)= 2CO(g)+2H2(g) △H="+247.4" kJ·mol-1
则CH4和H2O(g)反应生成CO2和H2的热化学方程式为:
(16分)物质在水溶液中可能存在电离平衡、盐的水解平衡
(1)有0.1 mol·L-1的(NH4)2SO4溶液,在该溶液中离子浓度由大到小的顺序为
。
(2)有0.1 mol·L-1的NaHCO3溶液,在该溶液中存在的平衡有三个,请分别用离子方程式表示:
_________________
。
(3)NH3·H2O 的电离方程式是,往氨水中加入少量醋酸铵固体(提示醋酸铵呈中性),C(OH-)(填“增大”“减小”“不变”)。
(4)已知某温度下K(NH3·H2O)=1.69×10-5,则该温度下0.1mol/L的氨水中C(OH-)= mol/L
(5)若将等pH、等体积的②NaOH溶液和⑦NH3·H2O溶液分别加水稀释m倍、n倍,稀释后两种溶液的pH仍相等,则m________(填“<”、“>”或“=”)n。