NA表示阿伏加德罗常数的值,下列说法正确的是
| A.标况下,22.4LNO2气体中含有NA个氮原子 |
| B.在Cu-Zn原电池中,正极产生1.12LH2时,负极产生了0.05 NA 个Zn2+ |
| C.常温常压下,1molCl2与足量的Fe反应转移3NA个电子 |
| D.标况下,将m1克锌加入到m2克20%的盐酸中放出nLH2,则转移电子数为nNA/11.2 |
六氟化硫分子呈正八面体形(如图所示),在高电压下仍有良好的绝缘性,在电器工业方面有着广泛的用途,但逸散到空气中会引起温室效应。下列有关六氟化硫的推测正确的是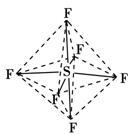
| A.六氟化硫易燃烧生成二氧化硫 |
| B.六氟化硫中各原子均达到8电子稳定结构 |
| C.六氟化硫分子中的S—F键都是σ键,且键长、键能都相等 |
| D.六氟化硫分子是极性分子 |
下列有关说法不正确的是
| A.C3H8中碳原子都采用的是sp3杂化 |
| B.O2、CO2、N2都是非极性分子 |
| C.酸性:H2CO3<H3PO4<H2SO4<HClO |
D.CO的一种等电子体为NO+,它的电子式为 |
下列各组微粒中,都互为等子体的是
| A.CO、NO、NaH、N2 | B.SO2、NO2+、N3-、CNO- |
| C.CO32-、NO3-、BeCl2 | D.SiF4、SiO44-、SO42-、PO43- |
下列几种氢键:①O—H…O,②N—H…N,③F—H…F,④O—H…N,其强度由强到弱的排列顺序是
| A.③①④② | B.①②③④ |
| C.③② | D.①④③② |
现有短周期主族元素X、Y、Z、R、T。R原子最外层电子数是电子层数的2倍;Y与Z能形成Z2Y、Z2Y2型离子化合物,Z与T形成的Z2T 化合物能破坏水的电离平衡。六种元素的原子半径与原子序数的关系如图所示。下列推断正确的是
| A.原子半径和离子半径均满足:Y<Z |
| B.氢化物的沸点排序 :Y>T>R |
| C.最高价氧化物对应的水化物的酸性 :T<R |
| D.由X、R、Y、Z四种元素组成的化合物水溶液一定显酸性 |