硅酸盐与二氧化硅一样,都是以硅氧四面体作为基本结构单元。硅氧四面体可以用投影图表示成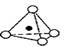 ,其中O表示氧原子,中心黑点表示硅原子。硅氧四面体通过不同方式的连接可以组成各种不同的多聚硅酸根离子。下图为某无限长单链的多聚硅酸根离子:
,其中O表示氧原子,中心黑点表示硅原子。硅氧四面体通过不同方式的连接可以组成各种不同的多聚硅酸根离子。下图为某无限长单链的多聚硅酸根离子:
试确定该阴离子中硅原子与氧原子的个数之比为
| A.1︰2 | B.1︰3 | C.1︰4 | D.2︰5 |
某烧碱溶液中含有少量杂质(不与盐酸反应),现用中和滴定测定其浓度下列操作会导致实验结果偏高的是
| A.滴加盐酸的过程中,未充分振荡,刚看到溶液变色,立刻停止滴定 |
| B.读取盐酸体积时,滴定前仰视,滴定后俯视 |
| C.盛标准盐酸的滴定管,滴定前无气泡,滴定后出现气泡 |
| D.若滴定前用蒸馏水洗涤锥形瓶和酸式滴定管后,均未经润洗就进行滴定 |
下列叙述中,正确的是
| A.中和10 mL 0.1 mol·L-1醋酸与中和100 mL 0.01 mol·L-1的醋酸所需同种碱溶液的量不同 |
| B.常温下,pH=3的甲酸溶液的c(H+)与pH=11的氨水溶液中,由水电离产生的c(OH-)相等 |
| C.向NH4Cl溶液中逐渐加入适量NaOH固体,溶液的导电性明显增强 |
| D.向饱和石灰水中加入少量CaO,恢复至室温后溶液中c(OH-)增大,导电能力增强 |
下列各组离子一定能大量共存的是
| A.pH=2的溶液中:SO42-、K+、NO3-、Mg2+ |
| B.pH试纸呈红色的溶液中:Fe2+、K+、NO3-、Na+ |
| C.水电离出的c(H+)=1×10-14mol·L-1的溶液中:Na+、Al3+、Cl-、SO42- |
| D.CO32-可以大量共存的溶液中:Ag+、K+、NO3-、Cl- |
A(g)+B(g) 2C(g)反应在密闭容器中进行,若保持容积不变,在温度分别为T1和T2时,达到平衡,B的体积分数与时间的关系如图所示。现向一体积可变的密闭容器中通入等物质的量的A气体和B气体,在恒温条件下发生反应达到平衡状态Ⅰ后,再升高到某温度,继续反应一段时间后达到平衡状态Ⅱ。下列叙述中正确的是
2C(g)反应在密闭容器中进行,若保持容积不变,在温度分别为T1和T2时,达到平衡,B的体积分数与时间的关系如图所示。现向一体积可变的密闭容器中通入等物质的量的A气体和B气体,在恒温条件下发生反应达到平衡状态Ⅰ后,再升高到某温度,继续反应一段时间后达到平衡状态Ⅱ。下列叙述中正确的是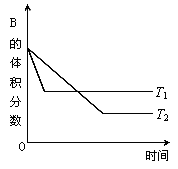
| A.T1>T2,该反应生成物的总能量高于反应物的总能量 |
| B.该反应在高温时才能自发进行 |
| C.由平衡状态Ⅰ到平衡状态Ⅱ的过程中,平衡向逆向移动,A的体积分数一直没有变化 |
| D.反应从开始到平衡状态Ⅱ的过程中,平衡常数K和A的转化率都是先增大后减少 |
将E和F加入密闭容器中,在一定条件下发生反应:E(g)+F(s) 2G(g)。忽略固体体积,平衡时G的体积分数(%)随温度和压强的变化如下表所示。下列推断不正确的是
2G(g)。忽略固体体积,平衡时G的体积分数(%)随温度和压强的变化如下表所示。下列推断不正确的是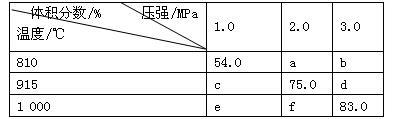
| A.该反应的△S>0 |
| B.915 ℃,2.0 MPa时E的转化率为60% |
| C.b>f |
| D.K(1000℃)>K(810℃) |