下列说法正确的是( )
| A.分子晶体中一定含有共价键 |
| B.稀有气体形成的晶体属于分子晶体 |
| C.干冰升华时,分子内共价键会发生断裂 |
| D.金属元素和非金属元素形成的化合物一定是离子化合物 |
下列关于“摩尔”的说法正确的是:
| A.摩尔是一个物理量 | B.摩尔是表示物质的量 |
| C.摩尔是物质的量的单位 | D.摩尔是表示物质数量的单位 |
下列仪器常用于物质分离的是
① ② ③④⑤ ⑥
| A.①③⑤ | B.②③⑤ | C.②④⑤ | D.①②⑥ |
用四氯化碳萃取碘水中的碘,下列说法中不正确的是:
| A.实验使用的主要仪器是分液漏斗 | B.碘在四氯化碳中的溶解度比在水中的溶解度大 | C.碘的四氯化碳溶液呈紫红色 | D.分液时,水从分液漏斗下口流出,碘的四氯化碳溶液从漏斗上口倒出 |
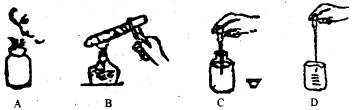
下列有关实验操作错误的是
| A.用药匙取用粉末状固体 | B.用胶头滴管滴加少量液体 |
| C.给盛有2/3体积液体的试管加热 | D.倾倒液体时试剂瓶标签向手心 |
下列图示的实验操作正确的是