从海水中提取溴的反应原理是5NaBr + NaBrO3 + 3H2SO4 = 3Br2 + 3Na2SO4 + 3H2O,下列反应的原理与上述反应最相似的是
A 2NaBr + Cl2 =" 2NaCl" + Br2
B KClO3 + 6HCl 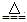 KCl + 3Cl2↑ + 3H2O
KCl + 3Cl2↑ + 3H2O
C 2H2S + SO2 =" 3S↓" + 2H2O
D AlCl3 + 3NaAlO2 + 6H2O = 4Al(OH)3↓ + 3NaCl
与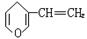 互为同分异构体,遇氯化铁溶液显紫色的有机物是
互为同分异构体,遇氯化铁溶液显紫色的有机物是
A.  |
B.  |
C.  |
D.  |
(Ⅰ)1-溴丙烷与2-溴丙烷分别和氢氧化钠的醇溶液混合加热;(Ⅱ)1-溴丙烷与2-溴丙烷分别和氢氧化钠的水溶液混合加热,则
| A.(Ⅰ)(Ⅱ)产物均相同 | B.(Ⅰ)(Ⅱ)产物均不同 |
| C.(Ⅰ)产物相同,(Ⅱ)产物不同 | D.(Ⅰ)产物不同,(Ⅱ)产物相同 |
a mol阿斯匹林(结构式为 )可跟足量的NaOH溶液反应,最多消耗NaOH的物质的量为
)可跟足量的NaOH溶液反应,最多消耗NaOH的物质的量为
| A.a mol | B.2a mol | C.3a mol | D.4a mol |
已知甲醛(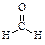 )分子中的四个原子是共平面的,下列分子中所有原子不可能同时存在同一平面上的是
)分子中的四个原子是共平面的,下列分子中所有原子不可能同时存在同一平面上的是
A.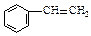 |
B.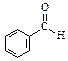 |
C.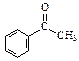 |
D.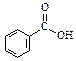 |
分子式为C3H6Cl2的有机物,发生一氯取代反应后,只生成一种物质,则原有机物(C3H6Cl2)应该是
| A.1,3—二氯丙烷 | B.1,1—二氯丙烷 |
| C.1,2—二氯丙烷 | D.2,2—二氯丙烷 |