铝是生活中非常常见的一种金属,运用所学知识回答:
(1)金属铝是活泼的金属,可在生活中应用很广泛,原因是 。
(2)铝盐或铁盐能用于净水,是因为铝盐或铁盐在水溶液中形成了 。
(3)在一个瘪了的铝制易拉罐加入适量的NaOH溶液,并密封,易拉罐会慢慢复原,原因是(用化学方程式表示) 。
(4)铝粉与氧化铁粉末在高温下得到铁的反应叫做“铝热反应”,发生反应的化学方程式为 。
煤的直接燃烧已引起严重的生态和环境污染,并且其直接燃烧很难解决温室气体减排问题。解决煤炭的清洁高效利用问题是中国发展低碳经济的关键。下图是煤气化和除硫的实验系统示意图: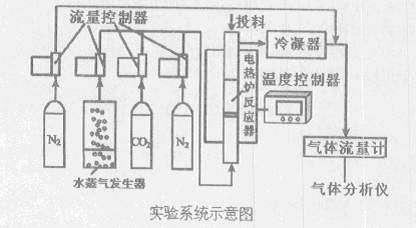
其操作步骤为:
I.升温至实验温度,通人高纯N2,从投料口加人石英砂(含载氧体)
Ⅱ.停止通入N2,从反应器下方按比例通入水蒸气和CO2,从投料口加入CaO
Ⅲ.停止通入水蒸气和CO2,从投料口加入煤
Ⅳ.持续通入水蒸气和CO2,开始反应;在气体出口管中通人高纯N2
(1)冷凝器的作用是。
(2)可使用CaCO3代替CaO脱硫,CaCO3脱硫的化学方程式为。
(3)通人N2的目的:。
(4)反应器中发生如下几种反应:
C(s)十H2O(g)=CO(g)+H2(g)△H=+131kJ/mol
C(s)+O2(g)=CO2(g)△H=-394kJ/mol
CO(g)+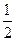 O2(g)=CO2(g)△H=-283kJ/mol
O2(g)=CO2(g)△H=-283kJ/mol
CO(g)+H2O(g)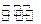 H2(g)+CO2(g)
H2(g)+CO2(g)
下图能表示CO与H2O(g)生成CO2和H2的反应过程和能量关系的图是(填序号)。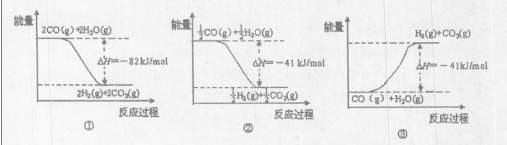
(5)已知830℃时,CO(g)+H2O(g)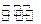 H2(g)+CO2(g)的平衡常数K=1,等物质的量的CO和H2O反应达到平衡时,CO的转化率为.
H2(g)+CO2(g)的平衡常数K=1,等物质的量的CO和H2O反应达到平衡时,CO的转化率为.
(6)煤气化过程中会生成少量CH4,已知CH4与CaSO4反应生成CaS、CO2和H2O,该反应中氧化剂与还原剂的物质的量之比为。
(7)煤气化后,混合气体由CO、H2和CH4等组成,可用于制燃料电池。其中碱性条件下CH4参与反应的电极反应式为。
镁砂(MgO)是一种高温耐火材料。下图是氨法制取高纯镁砂的部分工艺流程: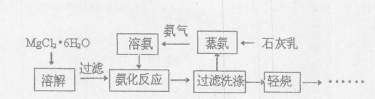
请回答:
(1)MgCl2·6H2O溶于水,溶液呈(填“酸性”、“中性”或“碱性”)。
(2)写出氨气的电子式。
(3)蒸氨是将石灰乳通人氯化铵溶液中并加热,写出该反应的化学方程式:。
(4)轻烧后的产物为。
(5)过滤洗涤主要是除去附着在固体表面的氯离子,检验沉淀已洗涤干净的方法是。
(6)氨化反应过程中反应的离子方程式为。
(7)已知向Mg(OH)2沉淀中滴加氯化铵溶液可观察到沉淀溶解,该实验应注意使用饱和氯化铵溶液、边滴加边振荡,试解释该反应发生的原理(用离子方程式表示和文字说明)。
(4分)A、B、C、D四种气体,都是大气的污染物。国家环境保护法严格禁止把这类气体大量排入空气中,工业上通常都用碱液加以吸收。已知A的水溶液是一种无氧酸,A在空气中充分燃烧得到B;B是形成酸雨的主要污染物;C是一种单质,其水溶液具有漂白作用;D是硝酸工业尾气中有害物质之一,易溶于水。根据推断结果和下列要求写出有关的化学方程式。
(1) A在空气中完全燃烧:。
(2) B的水溶液被空气氧化:。
(3) C跟消石灰反应:。
(4) D跟水反应:。
(10分)X、Y、Z、M是元素周期表中前20号元素,其原子序数依次增大,且X、Y、Z相邻。X的核电荷数是Y的核外电子数的一半,Y与M可形成化合物M2Y。用微粒符号完成下列问题:
(1)Y、Z两种元素的最高价氧化物的水化物酸性___________强于___________。
(2)M、Z、Y形成的简单离子的半径的大小________________。
(3)M2X2固体中阴、阳离子个数比____________,其电子式为_______________。该物质中含有化学键的类型有______________和______________。
(4)将Z的单质通入YX2的水溶液中发生反应的离子方程式为____________。
(10分)在短周期元素中:①金属性最强的元素是______,与水反应最剧烈的非金属是_____;②地壳中含量最丰富的元素位于第________周期第________族,地壳中含量最多的金属元素位于周期表的第________周期第________族.
在11~18号的元素中,③原子半径最小的元素是________,阳离子半径最小的是________,阴离子半径最小的是________,④元素最高价氧化物中既能与盐酸反应又能与烧碱反应,该氧化物是________.