Ⅰ溴被称为海洋元素,向盐卤中通入氯气可制得溴:Cl2 + 2NaBr =" 2NaCl" + Br2,该反应被氧化的元素为 ▲ (写元素符号);若上述反应制得16g Br2 ,则转移的电子数目是 ▲ 个。
Ⅱ请按要求书写化学方程式或离子方程式
(1)小明运用化学实验证明了久置于空气中的亚硫酸钠已变质,请用化学方程式表示亚硫酸钠变质的原因 ▲ 。
(2)FeSO4溶液用稀H2SO4酸化,放置一段时间后略显黄色,写出变化过程的离子方程式 ▲ ;然后向其中滴加KI-淀粉溶液变蓝色,写出变化过程的离子方程式 ▲ _。
已知A和B两只试管的溶液中含有K+、Ag+、Mg2+、Cl-、NO3-、OH-六种离子,向A试管中滴加酚酞溶液呈红色。请回答下列问题:
(1)A试管的溶液中含有上述离子有__________;若向A溶液中加入铝片写出该化学反应的离子方程式______________________________________________________________________;
(2)向某试管中滴加稀盐酸产生白色沉淀,则该试管为____________(填A或B);
(3)若将试管A和试管B的溶液按一定的体积比混合过滤后,蒸干可得到—种纯净物,则混合过程中发生反应的离子方程式______________、___________;
(4)若向试管A的溶液中的阳离子组成的碳酸氢盐溶液中,分别滴加盐酸和少量Ba(OH)2,则反应的离子方程式分别为_______________________、_____________________________________。
已知将盐酸滴入高锰酸钾溶液中,产生黄绿色气体(Cl2),而溶液的紫红色褪去。现有一个氧化还原反应的体系中,共有KCl、Cl2、H2SO4、H2O、KMnO4、MnSO4、K2SO4七种物质:
(1)该反应中,化合价升高的反应物是__________,化合价没有发生变化的反应物是_____________。
(2)该反应中,发生还原反应的过程是(填化学式)___________→____________。
(3)上述反应中,1 mol氧化剂在反应中______(填“得到”或“失去”)______mol电子。
(4)如果在反应后的溶液中加入NaBiO3,溶液又变紫红色,说出NaBiO3的一个化学性质:。
实验室可以用高锰酸钾和浓盐酸反应制取氯气,反应的化学方程式如下:
2KMnO4+16HCl(浓) 2KCl + 2MnCl2 + 5Cl2↑ +8H2O
(1)用单线桥法标出电子转移的方向和数目。
(2)该反应中的氧化剂与还原剂物质的量之比是。
(3)KMnO4的氧化性比Cl2的氧化性(选填“强”或“弱”)。
(4)如反应中转移了2mol电子,则产生的Cl2在标准状况下体积为L。
(5)某同学欲用KMnO4固体配制100 mL0.5mol.L-1的溶液。回答下列问题:
①配制KMnO4溶液时需用的主要仪器有托盘天平、药匙、烧杯、玻璃棒、量筒、 、。
②应用托盘天平称取KMnO4固体g。
③不规范的实验操作会导致实验结果的误差。分析下列操作对实验结果的影响偏小的是(请填序号)。
| A.加水定容时俯视刻度线 |
| B.容量瓶内壁附有水珠而未干燥处理 |
| C.颠倒摇匀后发现凹液面低于刻度线又加水补上 |
| D.在溶解过程中有少量液体溅出烧杯外 |
下表是周期表中的一部分,根据A~I在周期表中的位置,用元素符号或化学式回答下列问题:
| 族周期 |
ⅠA |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
0 |
| 1 |
A |
|||||||
| 2 |
D |
E |
G |
|||||
| 3 |
B |
C |
J |
F |
H |
I |
(1)表中元素,化学性质最不活泼的是,只有负价而无正价的是,可用于制半导体材料的元素是.
(2)最高价氧化物的水化物碱性最强的是,酸性最强的是,呈两性的是;
(3)A分别与D、E、F、G、H形成的化合物中,最稳定的;
(4)在B、C、D、J、E、F、G、H中,原子半径最大的是.
A是化学实验室中常见的有机物,它易溶于水并有特殊香味,B的产量可衡量一个国家石油化工发展的水平,并能进行如图所示的多种反应.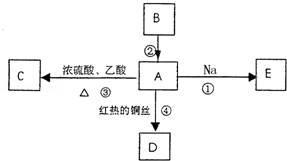
(1)写出A的化学式
(2)写出下列反应的化学方程式
反应①:
反应③:
反应④:
(3)比较反应①与钠和水反应的现象有什么相同和不同
相同点:
不同点: