早在1807年化学家戴维用电解熔融氢氧化钠制得钠: 4NaOH(熔)  4Na + O2↑+ 2H2O;后来盖·吕萨克用铁与熔融氢氧化钠作用也制得钠,反应原理为:3Fe+4NaOH
4Na + O2↑+ 2H2O;后来盖·吕萨克用铁与熔融氢氧化钠作用也制得钠,反应原理为:3Fe+4NaOH Fe3O4+2H2↑十4Na↑。下列有关说法正确的是
Fe3O4+2H2↑十4Na↑。下列有关说法正确的是
| A.电解熔融氢氧化钠制钠,阳极发生电极反应为:2OH--2e-=H2↑+O2↑ |
| B.盖·吕萨克法制钠原理是利用铁的还原性比钠强 |
| C.若戴维法与盖·吕萨克法制得等量的钠,则两反应中转移的电子总数也相同 |
| D.目前工业上常用电解熔融氯化钠法制钠(如上图),电解槽中石墨极为阳极,铁为 |
阴极
实验室进行NaCl液蒸发时,一般有以下操作过程
①固定铁圈位置;②放置酒精灯;③放上石棉网;④放上蒸发皿;⑤加热搅拌;⑥停止加热、余热蒸干,正确的操作顺序为
| A.①②③④⑤⑥ | B.②①③④⑤⑥ |
| C.②①④⑤⑥ | D.①②④⑤⑥ |
要除去混在CO2气体中少量CO,最好的方法是
| A.点燃 | B.通氧气并点燃 | C.NaOH溶液 | D.过灼热的氧化铜 |
在100g浓度为18mol/L,密度为ρ(g/cm3)的浓硫酸中加入一定量的水(密度为1g/cm3)稀释成9mol/L的硫酸,则加入水的体积为
| A.大于100mL | B.小于100mL | C.等于100mL | D.等于100/ρmL |
在150℃时碳酸铵可以受热完全分解[(NH4)2CO3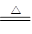 2NH3↑+H2O↑+CO2↑],则其完全分解后所产生的气态混合物的密度是相同条件下氢气密度的
2NH3↑+H2O↑+CO2↑],则其完全分解后所产生的气态混合物的密度是相同条件下氢气密度的
| A.48倍 | B.24倍 | C.12倍 | D.96倍 |
若50滴水正好是m mL,则1滴水所含的分子数是
| A.m×50×18×6.02×1023 | B. |
C. |
D.  |