下表为元素周期表前三周期的一部分,下列有关R、W、X、Y、Z五种元素的叙述中,正确的是
| A.常压下五种元素的单质中Z单质的沸点最高 |
| B.Y、Z、W的阴离子的还原性强弱顺序为:Z— >Y2—>W3— |
| C.最高价含氧酸的酸性强弱顺序为:H2YO4>HZO4>H3WO4 |
| D.五种元素对应的单质固态时均为分子晶体 |
反应N2(g)+3H2(g) 2NH3(g) ΔH <0,在其他条件不变的情况下,下列说法正确的是
2NH3(g) ΔH <0,在其他条件不变的情况下,下列说法正确的是
| A.增加氮气的量,平衡正向移动,上式中ΔH增大 |
| B.增大压强,平衡正向移动,平衡常数增大 |
| C.升高温度,平衡逆向移动,正反应速率增大 |
| D.加入催化剂,反应速率增大,氢气转化率增大 |
利用化石燃料开采、加工过程产生的H2S废气通过电化学法制取氢气的工艺如图,下列说法不正确的是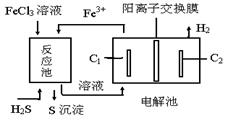
| A.反应池中的离子方程式:2Fe3++S2—=2Fe2++S↓ |
| B.该工艺优点之一是FeCl3溶液可循环利用 |
| C.电解池中惰性电极C1为阳极 |
D.电解池总反应的化学方程式: |
25℃时,某溶液中含有Na+、H+、Fe3+、HCO3-、OH-、I-中的几种离子,已知由水电离出的c(H+)=1.0×10-13mol·L-1。向该溶液中缓慢通入一定量的Cl2后,溶液由无色变为黄色。下列关于该溶液的分析,错误的是
| A.pH="l" 或 pH=13 |
| B.阴离子肯定有I—,不能确定有无HCO3— |
| C.阴离子肯定没有Fe3+,不能确定有无Na+ |
| D.溶质有3种可能:①HI ②HI和NaI ③NaI和NaOH |
对于常温下pH=2的盐酸和pH=3的醋酸,下列说法正确的是
| A.pH=3的醋酸中:c(H+)=3.0 mol·L-1 |
| B.pH=2的盐酸中:c(H+)=c(Cl-) + c(OH-) |
| C.pH=2的盐酸与pH=3的醋酸中溶质的物质的量浓度之比为10:1 |
| D.pH=3的醋酸与pH=11的NaOH溶液等体积混合所得溶液中:c(Na+)=c(CH3COO-) |
四种短周期元素在周期表中的位置如图,其中Y元素被称为“国防金属”。下列说法不正确是
| Z |
|||
| X |
Y |
W |
A.X离子结构示意图:
B.原子半径Y比Z大
C.元素的气态氢化物的稳定性Z强于W
D.X和Y两元素的最高价氧化物的对应水化物能相互反应