相同温度下,体积均为0.5 L的两个恒容密闭容器中发生可逆反应:
2XY2(g) + Y2(g)  2XY3(g) △H=-Q kJ·mol-1(Q>0)
2XY3(g) △H=-Q kJ·mol-1(Q>0)
实验测得反应在起始、达到平衡时的有关数据如下表所示:
| 容器 编号 |
起始时各物质物质的量/mol |
达平衡时体系能量的变化 |
||
| XY2 |
Y2 |
XY3 |
||
| ① |
2 |
1 |
0 |
放热 0.25 Q kJ |
| ② |
1.2 |
0.6 |
0.8 |
|
下列叙述不正确的是
A.容器①、②中反应的平衡常数均为1/13.5
B.达到平衡时,两个容器中Y2的物质的量浓度均为1.5 mol·L-1
C.容器②中反应达到平衡时放出的热量为0.15 Q kJ
D.若容器①的其他条件不变,恒压下通入稀有气体,则达到平衡时放出的热量小于0.25 Q kJ
下列说法不正确的是()
| A.除去干燥CO2中混有的少量SO2,可将混合气体依次通过盛有酸性KMnO4溶液、浓硫酸的洗气瓶 |
| B.“硝基苯制备”实验中,将温度计插入水浴,但水银球不能与烧杯底部和烧杯壁接触 |
| C.“中和滴定”实验中,容量瓶和锥形瓶用蒸馏水洗净后即可使用,滴定管和移液管用蒸馏水洗净后,必须干燥或润洗后方可使用 |
| D.变色硅胶干燥剂含有CoCl2,干燥剂呈蓝色时,表示不具有吸水干燥功能 |
氮化硅(SiN4)是一种新型陶瓷材料,它可由石英与焦炭在高温的氮气流中,通过以下反应制得:
3SiO2+6C+2N2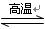 Si3N4+6CO。下列叙述正确的是()
Si3N4+6CO。下列叙述正确的是()
| A.在氮化硅的合成反应中,N2是还原剂,SiO2是氧化剂 |
| B.上述反应中每生成1molSi3N4,N2得到12mol电子 |
| C.若已知上述反应为放热反应,升高温度,其平衡常数增大 |
| D.若使压强增大,上述平衡向正反应方向移动 |
下列图示与对应的叙述相符的是()
| A.图5表示某吸热反应分别在有、无催化剂的情况下反应过程中的能量变化 |
| B.图6表示0.1000 mol·L-1NaOH溶液滴定20.00mL0.1000 mol·L-1CH3COOH溶液所得的滴定曲线 |
| C.图7表示KNO3的溶解度曲线,图中a点所示的溶液是80℃时KNO3的不饱和溶液 |
| D.图8 表示某可逆反应生成物的量随反应时间变化的曲线,由图知t时反应物转化率最大 |
短周期元素W、X、Y和Z的原子序数依次增大。元素W是制备一种高效电池的重要材料,X原子的最外层电子数是内层电子数的2倍,元素Y是地壳中含量最丰富的金属元素,Z原子的最外层电子数是其电子层数的2倍。下列说法错误的是()
| A.元素W、X的氯化物中,各原子均满足8电子的稳定结构 |
| B.元素X与氢形成的原子比为1:1的化合物有很多种 |
| C.元素Y的单质与氢氧化钠溶液或盐酸反应均有氢气生成 |
| D.元素Z可与元素X形成共价化合物XZ2 |
下列叙述正确的是()
A.Fe分别与氯气和稀盐酸反应所得氯化物相同
B.K、Zn分别与不足量的稀硫酸反应所得溶液均呈中性
C.Li、Na、K的原子半价和密度随原子序数的增加而增大
D.C、P、S、Cl的最高价氧化物对应水化物的酸性逐渐增强