有机物A~F存在如 下转化关系,A的化合物的水溶液呈弱酸性,A、C分子中含C、H两元素的质量分数和均为85
下转化关系,A的化合物的水溶液呈弱酸性,A、C分子中含C、H两元素的质量分数和均为85 .19%,相对分子质量均为108。F含两个环且有一个对位甲基。
.19%,相对分子质量均为108。F含两个环且有一个对位甲基。
请回答下列问题:
(1)写出化合物A的分子式____________,B的结构简式________________。
(2)与C具有相同环的同分异构体共有_____________(含C)种,请写出其中两种不同类别有机物的结构简式(除C外)__________________、______________________。
(3)A中处于同一平面上的原子最多有__________个。
(4)写出F的结构简式____________________。
(5)写出反应④的化学方程式_________________________________
苏打和小苏打有着广泛应用,试从反应物用量角度说明,在下列用途中选(A)苏打,还是(B)小苏打,并说明原因。
(1)做面条时防止面粉较长时间储存变酸味,常加入适量的碱面,选用________,因为________。
(2)作为泡沫灭火器的药品,选用________,因为________。
(3)用于洗涤餐具及实验室的玻璃仪器等,选用________,因为________(提示:二者水溶液均显碱性,且苏打的碱性强)。
(4)治疗胃酸过多时,选用________,因为________。
A、B、C、D、E五种物质都含有同一元素,它们按下图所示关系相互转化,已知A为单质。
(1)写出A~E的化学式
(2)分别写出有关反应的化学方程式,其中属于氧化还原反应的,请标出电子转移的方向和数目
①A→B:________②A→C:________③A→D:________
④C→D:________⑤C→E:________⑥D→E:________
工业上为了处理含有Cr2O72-的酸性工业废水,采用下列的处理方法:是绿矾(FeSO4·7H2O),把废水中的六价铬离子还原成三价铬离子,再加入过量的石灰水,使铬离子转变为Cr(OH)3沉淀。其主要的化学方程式如下:
H2Cr2O7+6FeSO4+6 H2SO4=Cr2(SO4)3+3Fe 2(SO4)3+7H2O
现用上述方法处理1×104L含铬(+6价)78mg/L的废水(Cr相对原子质量为52),请回答下列问题:
⑴处理后,沉淀物中除Cr(OH)3外,还有.(用化学式表示)。
⑵需用绿矾的质量。
FeS饱和溶液中存在溶解平衡:FeS(s)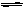 Fe2+(aq)+S2-(aq),常温下Ksp = [Fe2+]·[ S2-]=8.1×10-17 mol2/L2。由此请回答:
Fe2+(aq)+S2-(aq),常温下Ksp = [Fe2+]·[ S2-]=8.1×10-17 mol2/L2。由此请回答:
⑴理论上FeS的溶解度为。
⑵又知FeS饱和溶液中[H+]与[ S2-]之间存在着如下关系:[H+]2·[ S2-]=1.0×10-22 mol3/L3,为了使溶液里[Fe2+]达到了1mol/L,现将FeS适量投入到其饱和溶液中,应调节溶液中的[H+]为。
牙齿表面由一层硬的成分Ca5(PO4)3OH的物质保护着,它在唾液中存在下列平衡:
Ca5(PO4)3OH(s)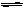 5Ca2+(aq)+3PO43-(aq) +OH-(aq)
5Ca2+(aq)+3PO43-(aq) +OH-(aq)
进食后,细菌和酶作用于食物,产生有机酸,这时牙齿就会受到腐蚀,其原因是_______
。
已知Ca5(PO4)3F的溶解度比上面的矿化物更小,质地更坚固,请用离子方程式表示,当牙膏中配有氟化物添加剂后能防止龋齿的原因_________________________。
根据以上原理请你提出另外一种促进矿化的方法_______________________。