(1)现有下列A、B两组物质:
A组:CH3—CHCl—CH3、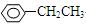 、HCOOH、CH3COOC2H5 。
、HCOOH、CH3COOC2H5 。
B组:CH3CH2CH2OH、银氨溶液、NaOH溶液、Na2CO3溶液。 试回答:
①A组中 能跟B组中所有物质都可发生反应。
②B组中 可跟A组中三种物质反应。
(2)CH3OH、A、B分子量依次增大14,但彼此不是同系物,请写出符合条件的
A、B的结构简式,A B (写出一组即可)
(1)用活性炭还原法可以处理氮氧化物。某研究小组向某密闭容器中加入一定量的活性炭和NO,发生反应C(s)+2NO(g)  N2(g)+CO2(g)△H="Q" kJ·mol-1。在T1℃时,反应进行到不同时间测得各物质的浓度如下:
N2(g)+CO2(g)△H="Q" kJ·mol-1。在T1℃时,反应进行到不同时间测得各物质的浓度如下:
 浓度 浓度 |
0 |
10 |
20 |
30 |
40 |
50 |
| NO |
1.00 |
0.68 |
0.50 |
0.50 |
0.60 |
0.60 |
| N2 |
0 |
0.16 |
0.25 |
0.25 |
0.30 |
0.30 |
| CO2 |
0 |
0.16 |
0.25 |
0.25 |
0.30 |
0.30 |
①0~10min内,NO的平均反应速率v(NO)=,T1℃时,该反应的平衡常数K=。
②30min后,只改变某一条件,反应重新达到平衡,根据上表中的数据判断改变的条件可能是(填字母编号)。
a.通入一定量的NO b.加入一定量的活性炭
c.加入合适的催化剂 d.适当缩小容器的体积
③若30min后升高温度至T2℃,达到平衡时,容器中NO、N2、CO2的浓度之比为3:1:1,Q0
(填“>”或“<”)。
④在恒容条件下,能判断该反应一定达到化学平衡状态的依据是(填选项编号)。
a.单位时间内生成2n mol NO(g)的同时消耗n mol CO2(g)
b.混合气体的平均相对分子质量不再改变
c.混合气体的密度不再发生改变
d.反应体系的压强不再发生改变
(2)若以下图所示装置,用电化学原理生产硫酸,写出通入SO2电极的电极发生(填“氧化”或“还原”)反应,电极反应式为。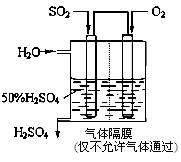
Ⅰ.铁是一种过渡元素,金属铁是最常用的金属之一。请回答下列问题:
(1)生铁中含有一种铁碳化合物(Fe3C),在足量的空气中高温煅烧,生成有磁性的固体和能使澄清石灰水变浑浊的气体,该反应的化学方程式为,上述反应生成的磁性固体与过量浓硝酸反应后的溶液中含有的盐的化学式为。
(2)硫酸厂用煅烧黄铁矿(FeS2)来制取硫酸,实验室利用硫酸厂烧渣(主要成分是Fe2O3及少量FeS、SiO2)制备绿矾。利用烧渣制绿矾的过程如下: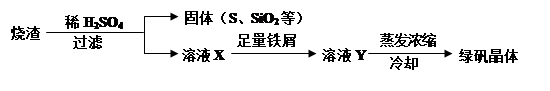
①烧渣溶于稀H2SO4过程中,有单质硫生成,写出该反应的离子方程式(只写生成S的反应式,其他反应无需写出)。
②向溶液X中加入足量铁屑的目的是。
(3)已知Fe(OH)3的溶度积常数Ksp=1.1×10-36。室温时向FeCl3溶液中滴加NaOH溶液,当溶液pH=3时,通过计算说明Fe3+是否沉淀完全)
(提示:当某离子浓度小于10-5mol•L-1时可以认为该离子沉淀完全了)。
Ⅱ.(1)某溶液中有Mg2+、Fe3+、Al3+、Cu2+等离子,向其中加入过量的NaOH溶液后,过滤,将滤渣高温灼烧并将灼烧后的固体投入到过量的稀盐酸中,所得溶液与原溶液相比,溶液中大量减少的金属阳离子是________;用离子方程式解释其原因_________________。
(2)在25℃下,向浓度均为0.01 mol・L-1的MgCl2和AlCl3混合溶液中逐滴加入氨水,先生成__________沉淀(填化学式),生成该沉淀的离子方程式______________(已知25℃时Ksp[Mg(OH)2]=1.8×10-11 Ksp[Al(OH)3]="3×10" -34)。
(3)将Mg、Cu组成的1.96g混合物投入过量稀硝酸中,充分反应后,固体完全溶解时收集到还原产物NO气体0.896L(标准状况),向反应后的溶液中加入2mol/L的NaOH溶液80mL时金属离子恰好完全沉淀。则形成沉淀的质量为g。
铁及铁的化合物应用广泛,如FeCl3可用作催化剂、印刷电路铜板腐蚀剂和外伤止血剂等。
(1)写出FeCl3溶液腐蚀印刷电路铜板的离子方程式 。
(2)若将(1)中的反应设计成原电池,请画出原电池的装置图,标出正极、负极,并写出电极反应。
正极反应 ;
负极反应 。
某兴趣小组为了提高电池的效率,设计了下图所示的原电池。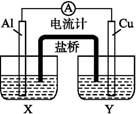
请回答下列问题:
(1)若X是AlCl3溶液,Y是稀硫酸,请你写出电极名称及电极反应:
Al片( ) , Cu片( ) 。
(2)若X是浓硝酸,Y是NaCl溶液,请你写出电极名称及电极反应:
Al片( ) , Cu片( ) 。
A、B、C三个烧杯中分别盛有相同物质的量浓度的稀硫酸,如下图所示: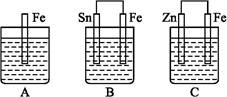
(1)A中反应的离子方程式为 。
(2)B中Sn极的电极反应式为 ,Sn极附近溶液的pH (填“升高”“降低”或“不变”)。
(3)C中被氧化的金属是 ,总反应式为 。