a、b、c、d、e分别是Cu、Ag、Fe、Al、Mg五种金属中的一种。已知:(1)a、c均能与稀硫酸反应放出气体;(2)b与d的硝酸盐反应,置换出单质d;(3)c与强碱溶液反应放出气体;(4)c、e在冷的浓硫酸中发生钝化。由此可判断a、b、c、d、e依次为
| A.Fe Cu Al Ag Mg | B.Al Cu Mg Ag Fe |
| C.Mg Cu Al Ag Fe | D.Mg Ag Al Cu Fe |
化学平衡常数(K)、弱酸的电离平衡常数(Ka)、难溶物的溶度积常数(Ksp)是判断物质性质或变化的重要的平衡常数。下列关于这些常数的说法中,正确的是( )
| A.平衡常数的大小与温度、浓度、压强、催化剂等有关 |
| B.当温度升高时,弱酸的电离平衡常数Ka变小 |
| C.Ksp(AgCl)>Ksp(AgI),由此可以判断AgCl(s)+I-(aq)=AgI(s)+Cl-(aq)能够发生 |
| D.Ka(HCN)<Ka(CH3COOH),说明物质的量浓度相同时,氢氰酸的酸性比醋酸强 |
某化工厂废水中含有Ag+、Pb2+等重金属离子,其浓度各约为0.01 mol·L-1。排放前拟用沉淀法除去这两种离子,查找有关数据如下:
在下列试剂中沉淀效果最好的是( )
| A.NaOH | B.Na2S | C.KI | D.Ca(OH)2 |
常温时,下列叙述正确的是( )
| A.稀释pH=10的氨水,溶液中所有离子的浓度均降低 |
| B.pH均为5的HCl和NH4Cl溶液中,水的电离程度相同 |
| C.NaOH和CH3COONa的混合溶液中,c(Na+)+c(H+)=c(OH-)+c(CH3COO-) |
| D.分别中和pH与体积均相同的硫酸和醋酸,硫酸消耗氢氧化钠的物质的量多 |
25 ℃时,关于浓度均为0.2 mol/L的Na2CO3和NaHCO3溶液的说法不正确的是( )
| A.两溶液中均存在电离平衡和水解平衡 |
| B.两溶液分别加水稀释后,pH和KW均减小 |
| C.两溶液中均存在c(OH-)+2c(CO32—)+c(HCO3—)=c(Na+)+c(H+) |
| D.c(OH-)前者大于后者 |
盐MN溶于水的过程如图所示: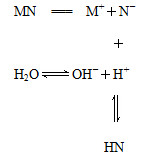
下列说法不正确的是( )
| A.MN是强电解质 |
| B.N-结合H+的能力一定比OH-强 |
| C.该过程中c(OH-)>c(H+) |
| D.溶液中存在c(HN)=c(OH-)-c(H+) |