下列说法正确的是
A.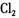 和 和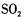 的漂白原理不同,混合使用效果更好 的漂白原理不同,混合使用效果更好 |
B. 测定等浓度的 测定等浓度的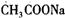 和 和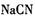 溶液的PH值分别为8.8和11.1,可以判断反应 溶液的PH值分别为8.8和11.1,可以判断反应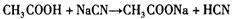 不能发生 不能发生 |
C.溶液中滴加盐酸酸化的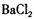 溶液出现白色沉淀,则溶液中一定存在 溶液出现白色沉淀,则溶液中一定存在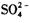 [ [ |
D.若通人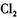 后,溶液变为黄色,加人淀粉溶液后变蓝色,可确定溶液中含有 后,溶液变为黄色,加人淀粉溶液后变蓝色,可确定溶液中含有 离子 离子 |
现有常温时pH=1的某强酸溶液10mL,下列操作能使溶液的pH变成2的是()
| A.加入10mL 0.01mol·L-1的NaOH溶液 | B.加入10mL 的水进行稀释 |
| C.加水稀释成100mL | D.加入10mL 0.01mol·L-1的盐酸溶液 |
常温下在给定的四种溶液中,加入以下各种离子,各离子能在原溶液中大量共存的有()
| A.滴加石蕊试液显红色的溶液:Fe3+、NH4+、Cl-、I- |
| B.pH值为1的溶液:Fe2+、Na+、Mg2+、NO3- |
| C.水电离出来的c(H+)=10-13mol/L的溶液:K+、HCO3-、Br-、Ba2+ |
| D.能与Al反应产生H2的溶液:K+、Na+、Clˉ、NO3ˉ |
常温下,已知下面三个数据:7.2×10-4、4.6×10-4、4.9×10-10分别是三种酸的电离平衡常数,若已知这些酸可发生如下反应:①NaCN+HNO2===HCN+NaNO2,②NaCN+HF===HCN+NaF,③NaNO2+HF===HNO2+NaF。
常温下,由此可判断下列叙述中,不正确的是()
| A.HF的电离平衡常数为7.2×10-4 |
| B.HNO2的电离平衡常数为4.9×10-10 |
| C.根据①③两个反应即可知三种酸的相对强弱 |
| D.HNO2的电离平衡常数比HCN大,比HF小 |
某温度下,分别稀释等pH值的盐酸和醋酸,溶液pH随加入水的体积变化的曲线如右图所示。据图判断下列说法正确的是()
| A.Ⅰ为醋酸稀释时pH变化曲线 |
| B.溶液的导电性:b>a>c |
| C.取“0”处等体积的两者溶液分别加足量铁粉,放出H2的量:醋酸>盐酸 |
| D.取5mL处等体积两者溶液分别与相同的Zn粒反应,开始时的反应速率:Ⅰ>Ⅱ |
已知温度T时水的离子积常数为Kω。该温度下,将浓度为a mol/L的一元酸HA与b mol/L的一元碱BOH等体积混合,可判定该溶液呈中性的依据是( )
| A.a=b |
| B.混合溶液的pH= 7 |
C.混合溶液中,c(H+) = mol/L mol/L |
| D.向反应后的混合液中滴加石蕊试液后呈紫色 |