下列叙述中的前后两个量之比为1 :2的是
| A.液面在 “ 0 ” 刻度时,25mL碱式滴定管和50mL碱式滴定管所盛液体的体积 |
| B.相同温度下,0.1mol /L乙酸溶液与0.2mol /L乙酸溶液中,c(H+)之比 |
C.氨水与(NH4)2SO4溶液混合后pH=7的溶液中,c(NH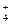 ): c(SO ): c(SO ) ) |
| D.相同温度下,pH=12的Ba(OH)2与pH=12的KOH溶液中,c〔(Ba(OH)2〕: c(KOH) |
已知2H2O2  2H2O+ O2↑,若其他条件不变,下列措施不能使该反应速率增大的是()
2H2O+ O2↑,若其他条件不变,下列措施不能使该反应速率增大的是()
| A.降低温度 |
| B.加入少量MnO2 |
| C.加入少量FeCl3 |
D.增大H2O2的浓度 |
下列反应中,属于吸热反应的是()
| A.Na与H2O反应 |
| B.Al与Fe2O3反应 |
| C.NaOH溶液与盐酸反应 |
| D.Ba(OH)2·8H2O晶体与NH4Cl晶体反应 |
在2A + B =" 3C" + 4D的反应中,下列表示该反应速率最大的是( )
| A.VA =0.5mol / (L.min) | B.VB =0.3mol / (L.min) |
| C.VA =0.8mol / (L.min) | D.VD =" 1mol" / (L.min) |
下列物质中,只含有共价键的是()
| A.HCl | B.MgCl2 | C.KBr | D.NaOH |
在右图所示的原电池中,下列说法正确的是()
A.正极反应为 Cu - 2e-  Cu2+ Cu2+ |
| B.溶液中H+向锌片移动 |
| C.电子由锌片通过导线流向铜 |
| D.该装置能将电能转化为化学能 |