海水蕴含着丰富的资源。在化学实验室里模拟从海水中提取重要的工业原料氯化钠时,设计了以下操作流程: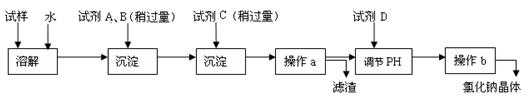
请回答以下问题:
(1)在所提供的试剂中选择:试剂C是
①Na2CO3 ②BaCl2 ③稀盐酸
(2)操作b中用到的主要仪器为酒精灯、 、三脚架和玻璃棒。
(3)利用所得的氯化钠制氯气和氢气,并检验氯气的氧化性和测定产生氢气的体积。试按下图所给仪器,设计一套能完成以上实验目的装置,仪器接口的正确连接顺序是:
A接 , 接 ;B接 , 接 。
(4)写出通入C后,烧杯中所发生的离子反应方程式
(5)电解氯化钠溶液时的离子方程式为
若装入的饱和食盐水为75mL,接通电源一段时间,停止通电后,测得氢气为8.4mL(标准状况)。将U形管内的溶液混合均匀,其pH约为_______ 。(假设电解前后溶液体积变化可忽略不计,产生的气体全部逸出)
(6)若想准确读取所得氢气的体积,应采取的操作有
下图是测定植物的某一生命活动过程的实验装置。A瓶中NaOH溶液的作用是__________________________________________________________________________,B瓶中的石灰水的作用是___________________________________________,D瓶中出现的现象是___________________________________________。此实验说明植物具有_________性质。
某化学课外小组的同学用Mg等与稀硫酸反应制H2,根据反应进行的情况,同学们得出了反应时间与产生H2的体积关系,并做出了如下图象。请回答:
(1)分析判断,_____________段化学反应速度最快,原因可能是___________________;
FG段化学反应速率较慢的原因可能是____________________________________________。
(2)为了降低该反应的反应速率,你认为可以采取哪些措施_________________(至少说出两种)。
电子工业使用的印刷线路板,是在敷有铜膜的塑料板上以涂料保护所需的线路,然后用FeCl3的溶液与未受保护的铜膜反应以去掉铜,腐蚀后的废液中含有大量的Cu2+。为了回收这一部分Cu2+并制成硫酸铜晶体(CuSO4·5H2O),常用如下步骤:
①向废液中加过量的铁屑,搅拌,静置;②滤出固体物质;③将滤出的固体物质加热煅烧;④把煅烧后的物质放在硫酸中溶解;⑤调节溶液的pH在3.4—4之间,使Fe(OH)3沉淀完全,过滤;⑥浓缩滤液,析出晶体;⑦将过滤得到的晶体溶解,再结晶。
(1)上述③步操作所得煅烧产物成分是_______________。
A.CuO B.CuO和FeO C.CuO和Fe2O3D.CuO和Fe3O4
(2)上述第⑤步操作中,调节溶液的pH宜加入的物质是_______________。
A.氧化铜粉末 B.NaOH溶液 C.稀氨水 D.Na2CO3
(3)上述第⑥步操作中,用浓缩滤液而不用蒸干溶液的主要原因是_______________。
A.蒸干所得到的物质可能含有无水硫酸铜
B.温度升高CuSO4溶解度增大
C.温度升高Cu2+被还原为Cu
D.温度升高CuSO4分解
现给你一试管二氧化氮,其他药品和仪器自选。试设计实验,要求尽可能多地使二氧化氮被水吸收。
| 实验步骤 |
现象 |
解释(可用化学方程式表示) |
|
| (1) |
|||
| (2) |
|||
| (3) |
某学生做钠在氯气中燃烧的实验时,使用了崭新的铜制燃烧匙,当钠燃烧时,除了观察到有白烟外,还有少量棕色的烟,能说明这个现象的化学方程式为
__________________,___________________________;将上述反应得到的固体溶于水后再加入NaOH溶液,产生少量蓝色沉淀,该反应的离子方程式为:
__________________________。