(13分) A~L均为化学实验室中常见的物质,它们有以下转化关系。其中:I是一种黄绿色有毒气体,B、D、E、G均为家庭中常见的物质,常温下,B为无色液体,L是一种具有水果香味的液体。试回答下列问题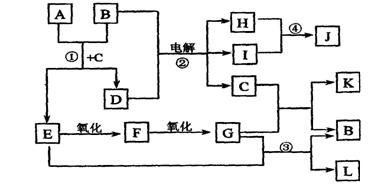
(1)A的名称: C的电子式:
(2)写出反应①的化学反应方程式
写出反应②的离子方程式
(3)实验室以E为原料制取一种植物生长调节剂的化学方程式为: .
(8分)德国人哈伯在1913年实现了合成氨的工业化生产,反应原理:
N2(g)+3H2(g) 2NH3(g);已知298 K时,
2NH3(g);已知298 K时,
ΔH=-92.4 kJ·mol-1,ΔS=-198.2 J·mol-1·K-1,试回答下列问题:
(1)计算说明298 K下合成氨反应能否自发进行?________(填“能”或“不能”);在298 K时,将10 mol N2和30 mol H2放入合成塔中,为什么放出的热量小于924 kJ?________。
(2)如图在一定条件下,将1 mol N2和3 mol H2混合于一个10 L的密闭容器中,反应达到A平衡时,混合气体中氨占25%,试回答下列问题:
①N2的转化率为________;
②在达到状态A时,平衡常数KA=________(代入数值的表达式,不要求得具体数值),当温度由T1变化到T2时,KA________KB(填“=”、“<”或“>”)。
③在达到状态B时,下列说法正确的是( )
a.通入氩气使压强增大,化学平衡向正反应方向移动
b.N2的正反应速率是H2的逆反应速率的1/3倍
c.降低温度,混合气体的平均相对分子质量变小
d.增加N2的物质的量,H2的转化率降低
(3)若在恒温、恒压条件下合成氨反应达到平衡后,再向平衡体系中通入氩气,平衡________移动(填“向左”“向右”或“不”)。
(4)在1998年希腊亚里斯多德大学的Marnellos和Stoukides采用高质子导电性的SCY陶瓷(能传递H+),实现了高温高压下高转化率的电化学合成氨,其实验装置如图:
则阴极的电极反应式为____________________________________________________。
(8分)将2 mol H2O和2 mol CO置于1 L容器中,在一定条件下加热至高温,发生如下可逆反应:
2H2O(g) 2H2(g)+O2(g) 2CO(g)+O2(g)
2H2(g)+O2(g) 2CO(g)+O2(g) 2CO2(g)
2CO2(g)
(1)当上述系统达到平衡时,欲求其混合气体的平衡组成,则至少还需要知道两种气体的平衡浓度,但这两种气体不能同时是________和________,或________和________。
(2)若平衡时O2和CO2的物质的量分别为n(O2)平=a mol,n(CO2)平=b mol。试求n(H2O)平=________。(用含a、b的代数式表示)
(8分)在2 L密闭容器内,800℃时反应2NO(g)+O2(g) 2NO2(g)体系中,n(NO)随时间的变化如表:
2NO2(g)体系中,n(NO)随时间的变化如表:
| 时间/s |
0 |
1 |
2 |
3 |
4 |
5 |
| n(NO)/mol |
0.020 |
0.010 |
0.008 |
0.007 |
0.007 |
0.007 |
(1)写出该反应的平衡常数表达式:K=________。
已知:K300℃>K350℃,则该反应是________热反应。
(2)如图中表示NO2的变化的曲线是________。用O2表示从0~2 s内该反应的平均速率v=________________________________________________________________________。
(3)能说明该反应已达到平衡状态的是________。
a.v(NO2)=2v(O2)
b.容器内压强保持不变
c.v逆(NO)=2v正(O2)
d.容器内密度保持不变
(4)能使该反应的反应速率增大,且平衡向正反应方向移动的是________。
a.及时分离出NO2气体 b.适当升高温度
c.增大O2的浓度 d.选择高效催化剂
硼酸在玻璃制造和医药领域应用广泛。
(1)元素周期表中存在“对角线”规则,硼与硅的某些化学性质类似,写出硼酸(H3BO3)加热至300℃时分解得到相应氧化物的化学方程式:。
(2)硼酸(H3BO3)溶液中存在如下反应:
H3BO3(aq)+H2O(l)  [B(OH)4] –(aq)+H+(aq) K=5.7×10–10(298K)
[B(OH)4] –(aq)+H+(aq) K=5.7×10–10(298K)
①实验中不慎将NaOH沾到皮肤时,用大量水洗后要涂上硼酸溶液。写出硼酸与NaOH反应的离子方程式。
②计算25℃时0.7mol·L–1硼酸溶液中H+的浓度。(写出计算过程,计算结果保留小数后一位)
(3)已知298K时:
| 化学式 |
碳酸 |
醋酸 |
| 电离常数 |
K1=4.4×10—7 K2=4.7×10—11 |
K=1.75×10—5 |
下列说法正确的是。
| A.碳酸钠溶液滴入硼酸中能观察到有气泡产生 |
| B.碳酸钠溶液滴入醋酸中能观察到有气泡产生 |
| C.等物质的量浓度的碳酸溶液和硼酸溶液比较,pH:前者>后者 |
| D.等物质的量浓度的碳酸氢钠溶液和醋酸钠溶液比较,pH:前者>后者 |
某有机物A在酸性溶液中加热可发生如下反应:
请回答下列问题:
(1)下列关于该有机物A说法错误的是。
①可发生银镜反应②1molA在一定条件下与氢气反应,最多可消耗5molH2
③能发生消去反应④1molA与烧碱溶液反应,最多可消耗4mol NaOH
(2)有机物B的化学式(分子式)为;B在铂的催化下,与足量氢气发生加
成反应生成X,则X的结构简式为。
(3)有机物R的结构简式为; R与足量的醋酸发生反应(填基本反应类型)的化学方程式为:
。