下列离子反应方程式书写正确的是
| A.FeCl2溶液中通入Cl2:Fe2+ +Cl2 ="==" Fe3+ + 2Cl- |
| B.实验室用固体氯化铵和熟石灰共热制取NH3: 2NH4++Ca(OH)2 ="==" 2NH3↑+ Ca2++H2O |
| C.FeO与稀HNO3反应:3FeO + 10H+ + NO3- ="==" 3Fe3+ + NO↑+5H2O |
| D.实验室用石灰石制CO2:CO32- + 2H+ ="==" CO2↑+ H2O |
下列关于Fe3+、Fe2+性质实验的说法错误的是 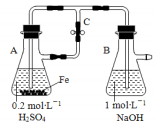
| A.用如图装置可以制备沉淀 Fe(OH)2 |
| B.配制FeCl3溶液时,先将氯化铁晶体溶于较浓的盐酸中,再加水稀释到所需要的浓度 |
| C.FeCl3溶液中滴加KSCN溶液会生成红色沉淀 |
| D.向FeCl2溶液中加入少量铁粉是为了防止Fe2+被氧化 |
已知H2(g)+I2(g)  2HI(g) ΔH<0,有相同容积的定容密封容器甲和乙,甲中加入H2和I2各0.2 mol,乙中加入HI0.4 mol,相同温度下分别达到平衡。欲使甲中HI的平衡浓度大于乙中HI的平衡浓度,应采取的措施是
2HI(g) ΔH<0,有相同容积的定容密封容器甲和乙,甲中加入H2和I2各0.2 mol,乙中加入HI0.4 mol,相同温度下分别达到平衡。欲使甲中HI的平衡浓度大于乙中HI的平衡浓度,应采取的措施是
| A.甲、乙提高相同温度 | B.甲降低温度,乙不变 |
| C.甲中加入0.2 mol He,乙不改变 | D.甲增加 0.2 mol H2,乙增加0.2 mol I2 |
在密闭容器中进行反应CH4(g)+H2O(g) CO(g)+ 3H2(g)ΔH>0 ,测得c(CH4) 随反应时间(t)的变化曲线如图所示。下列判断正确的是
CO(g)+ 3H2(g)ΔH>0 ,测得c(CH4) 随反应时间(t)的变化曲线如图所示。下列判断正确的是 
| A.0~5 min 内,v(H2)="0.1" mol·(L·min)-1 |
| B.反应进行到12 min时,CH4的转化率为 25% |
| C.恒温下,缩小容器的体积,平衡后 H2的浓度减小 |
| D.10 min 时,改变的外界条件可能是升高温度 |
一定温度下,在一固定体积的密闭容器中,可逆反应A(s)+3B(g) 2C(g)达到平衡时,下列说法正确的是
2C(g)达到平衡时,下列说法正确的是
①C的生成速率和C的分解速率相等; ②单位时间内生成a mol A,同时生成3a mol B;
③气体密度不再变化; ④混合气体的总压强不再变化;
⑤A、B、C的物质的量之比为1∶3∶2; ⑥混合气体的平均相对分子质量不变
A.②④⑤ B.①③④⑥ C.①②④⑥ D.①②③④⑤
下列实验不能达到目的的是
| A.用AlCl3溶液和过量氨水制备 Al(OH)3 |
| B.用NH4Cl 和Ca(OH)2固体混合加热制备NH3 |
| C.用NaOH溶液除去苯中的溴 |
| D.用足量铜粉除去 FeCl2溶液中的FeCl3杂质 |