下列依据热化学方程式得出的结论正确的是
| A.已知C(石墨, s)=C(金刚石, s); ΔH>0则石墨比金刚石稳定 |
| B.已知C(s)+O2(g)= CO2(g);ΔH1 C(s)+1/2O2(g)= CO(g);ΔH2则ΔH1>ΔH2。 |
| C.已知2H2(g)+ O2(g)= 2H2O(g);ΔH="-483.6kJ/mol" 则氢气的燃烧热为241.8 kJ/mol。 |
| D.已知NaOH(aq)+HCl(aq)=" NaCl(aq)" + H2O(l);ΔH="-57.3kJ/mol" 则含20gNaOH的稀溶液与稀盐酸完全中和,放出28.65kJ的热量 |
某溶液中可能含有下列6种离子中的某几种:Cl-、SO42-、CO32-、NH4+、Na+、K+。为确认溶液组成进行如下实验:(1)200 mL上述溶液,加入足量BaCl2溶液,反应后将沉淀过滤、洗涤、干燥,得沉淀4.30 g,向沉淀中加入过量的盐酸,有2.33 g沉淀不溶。(2)向(1)的滤液中加入足量的NaOH溶液,加热,产生能促使湿润红色石蕊试纸变蓝的气体1.12 L(已换算成标准状况,假定产生的气体全部逸出)。由此可以得出关于原溶液组成的正确结论是
| A.一定存在SO42-、CO32-、NH4+,可能存在Cl-、Na+、K+ |
| B.一定存在SO42-、CO32-、NH4+、Cl-,一定不存在Na+、K+ |
| C.c(CO32-)=0.01 mol·L-1,c(NH4+)>c(SO42-) |
| D.如果上述6种离子都存在,则c(Cl-)>c(SO42-) |
A、B、C、D为短周期元素,且原子序数依次增大。已知A原子的最外层电子数是其电子层数的2倍,B是地壳中含量最高的元素,B原子的最外层电子数是D原子最外层电子数的2倍,C原子最外层只有一个电子。下列说法正确的是
A.非金属性:A>B
B.四种元素中,C处于元素周期表中最左、下方,故原子半径最大
C.元素B和C只能形成一种化合物
D.A、C、D的最高价氧化物对应的水化物中没有两性氢氧化物
相同温度下,两个恒压密闭容器中发生可逆反应X2(g)+3Y2(g) 2XY3(g) ΔH=-92.6kJ·mol-1实验测得反应在起始及达到平衡时的有关数据如下表所示:
2XY3(g) ΔH=-92.6kJ·mol-1实验测得反应在起始及达到平衡时的有关数据如下表所示:
| 容器编号 |
起始时各物质物质的量/mol |
达平衡时体系能量变化 |
||
| X2 |
Y2 |
XY3 |
||
| ① |
0.1 |
0.3 |
0 |
4.63kJ |
| ② |
0.8 |
2.4 |
0.4 |
Q(Q>0)kJ |
下列叙述正确的是
A.反应的平衡常数:①>②
B.达平衡时,两个容器中XY3的物质的量浓度均为2mol·L-1
C.达到平衡时,容器①、②中各物质的百分含量相同
D.若容器①体积为0.20L,则达平衡时放出的热量大于4.63kJ
以NA代表阿伏加德罗常数,有关反应:C2H2(g)+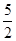 O2(g)→2CO2(g)+H2O(1);ΔH=-1300kJ/mol。下列关于热化学方程式的说法正确的是
O2(g)→2CO2(g)+H2O(1);ΔH=-1300kJ/mol。下列关于热化学方程式的说法正确的是
| A.有10NA个电子转移时,该反应放出1300kJ的能量 |
| B.有NA个水分子生成且为液体时,吸收1300kJ的能量 |
| C.有4NA个碳氧共用电子对生成时,放出1300kJ的能量 |
| D.有8NA个碳氧共用电子对生成时,吸收1300kJ的能量 |
可逆反应A(g)+3B(g) 2C(g);ΔH=-Q kJ/mol。有甲、乙两个容积相同且不变的密闭容器,向甲容器中加入1molA和3molB,在一定条件下达到平衡时放出热量为Q1 kJ在相同的条件下,向乙容器中加入2mol C达到平衡后吸收热量为Q2kJ,已知Q1=3Q2。下列叙述不正确的是
2C(g);ΔH=-Q kJ/mol。有甲、乙两个容积相同且不变的密闭容器,向甲容器中加入1molA和3molB,在一定条件下达到平衡时放出热量为Q1 kJ在相同的条件下,向乙容器中加入2mol C达到平衡后吸收热量为Q2kJ,已知Q1=3Q2。下列叙述不正确的是
A.甲中A的转化率为75%
B.Q1+Q2=Q
C.达到平衡后,再向乙中加入0.25 molA、0.75molB 、1.5molC,平衡向正反应方向移动
D.乙中的热化学反应方程式为2C(g) aA(g)+3B(g);ΔH=+Q2kJ·mol-1
aA(g)+3B(g);ΔH=+Q2kJ·mol-1