有一包粉末状固体,可能是由Al2(SO4)3、CuCl2、KNO3、Na2O中的一种或几种组成的。为了探究它的成分,某学习小组做了如下实验。
①取适量粉末投入蒸馏水中,粉末完全溶解,得到蓝色透明溶液A。
②取A溶液少量,向其中逐滴滴加烧碱溶液直到过量,观察到先有沉淀出现,而后沉淀逐渐增多,然后沉淀又逐渐减少,但最终仍有部分蓝色沉淀。
③再取A溶液两份,一份滴加BaCl2溶液后,出现白色沉淀;另一份滴加硝酸银溶液后也出现白色沉淀。请回答下列问题:
(1)原白色粉末一定含有  ,一定不含 ,可能含有 。(填化学式)
,一定不含 ,可能含有 。(填化学式)
(2)写出过程②中涉及到的离子方程式:
 。
。
(3)如果要进一步确定可能存在的物质,进行的实验操作及实验现象和结论是
。
有机物A的分子中碳氢原子数之比为1:2。它不与碳酸钠反应,相同物质的量的A与氢气的质量比为37:1 。0.37g A与足量的银氨溶液反应可析出1.08g Ag.A在一定条件下与氢气反应生成B,1mol B 与足量金属钠反应可产生22.4LH2(标准状况下),B不与碳酸钠反应.写出所有符合条件的A、B的结构简式。
AB
课本的第27页介绍了一种热带雌蚕蛾为了吸引同类雄蛾会分泌出叫“蚕蛾醇”的物质。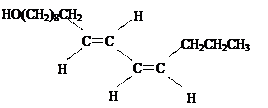
蚕蛾醇有多种顺反异构体,如请回答:
(1)蚕蛾醇共有多少种顺反异构体(含自身)。
(2)当分子中有1个碳原子分别连有4个不同的原子或原子团时,该碳原子称为手性碳原子。则该蚕蛾醇手性碳原子数为。
(3)该蚕蛾醇的分子式为。
(4)该蚕蛾醇不具有的性质是(从下面序列中选择序号填入)
①与钠反应②氧化③加聚④加成⑤NaOH中和反应
有机物A 0.02 mol 在氧气中完全燃烧生成4.4g CO2和2.16g H2O,无其它物质生成。试回答下列问题:
⑴下列说法中正确的是(填写序号)
| A.该化合物肯定含O元素 | B.该化合物可能不含O元素 |
| C.该化合物肯定不能和Na反应 | D.该分子中C:H的个数比为5:12 |
⑵若A为烃,且它的一卤代物只有一种结构,此烃的结构简式为:。用系统法命名为:。此烃共有种同分异构体。
⑶若A为一元醇且不能被氧气催化氧化。则A的结构简式为,其名称(系统命名)为,1mol醇A与足量钠反应,可生成H2的体积为L(STP)
(4分)(1)苯与浓硝酸、浓硫酸的混合物在温度100~110℃时的主要反应
(2)2-丁醇被氧气催化氧化的化学反应方程式___________________________
(9分)
烟气中NOX是NO和NO2的混合物 (1)根据废气排放标准,1 m3烟气最高允许含400 mg NOx。若NOX中NO质量分数为0.54,则100 m3烟气中最高允许含NOx __________L(标准状况),最高允许NOx分子数目为。
(1)根据废气排放标准,1 m3烟气最高允许含400 mg NOx。若NOX中NO质量分数为0.54,则100 m3烟气中最高允许含NOx __________L(标准状况),最高允许NOx分子数目为。
(2)如果用溶质质量分数为0.106的Na2CO3水溶液(密度1.1 g/mL)作为NOx吸收剂,该碳酸钠溶液物质的量浓度为____________mol/L。 (3)已知:
(3)已知:

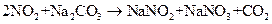 (NO
(NO 不能直接被Na2CO3水溶液吸收)
不能直接被Na2CO3水溶液吸收)
1000 m3(1)中所述烟气尽可能被(2)中所述Na2CO3水溶液吸收,至少需要L Na2CO3水溶液(保留2位小数),烟气中NOx(填“能”或 “不能”)被除尽。
“不能”)被除尽。