将一定量A、B装入容积为1 L的恒温密闭容器中,发生反应:2A (s)+bB (g) cC (g),1 min时达到平衡,C的浓度为x mol·L-1。若保持温度不变,将密闭容器的容积压缩为原来的一半,重新达到平衡后,C的浓度为2.5x mol·L-1。下列说法正确的是
cC (g),1 min时达到平衡,C的浓度为x mol·L-1。若保持温度不变,将密闭容器的容积压缩为原来的一半,重新达到平衡后,C的浓度为2.5x mol·L-1。下列说法正确的是
A.化学计量数的关系:b<c
B.容器的容积减小后,该反应的逆反应速率减小
C.若保持温度和容器的容积不变,充入氦气(不参与反应),平衡不发生移动
D.原容器中用B的浓度变化表示该反应在1 min内的速率为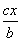 mol·L-1·min-1
mol·L-1·min-1
下面的排序不正确的是
| A.熔点由低到高:CH4<SiH4<GeH4<SnH4 |
| B.熔点由高到低:Rb>K>Na |
| C.硬度由大到小:金刚石>碳化硅>晶体硅 |
| D.晶格能由大到小:NaF>NaCl>NaBr>NaI |
A、B、C均为短周期的元素,A、B同周期,A、C的最低价离子分别为A2-和C-,B2+和C-具有相同的电子层结构,下列说法正确的是
A.C元素的最高正价为+7价
B.原子半径:A>B>C
C.离子半径:A2->C->B2+
D.还原性:A2-<C-
长式周期表共有18个纵行,从左到右排为1—18列,即碱金属为第一列,稀有气体元素为第18列。按这种规定,下列说法正确的是
| A.第9列元素中没有非金属元素 |
| B.只有第二列的元素原子最外层电子排布为ns 2 |
| C.第四周期第9列元素是铁元素 |
| D.第10、11列为ds区 |
下列说法正确的是
| A.分子晶体中一定不含离子键,但一定存在共价键 |
| B.金属与非金属元素形成的化合物一定是离子化合物 |
| C.NCl3分子中所有的原子均为8电子稳定结构 |
| D.NaHSO4晶体中阴、阳离子的个数比是1∶2 |
下列关于杂化轨道的叙述中,不正确的是
| A.分子中中心原子通过sp2杂化轨道成键时,该分子不一定为平面三角形结构 |
| B.杂化轨道只用于形成σ键或用于容纳未参与成键的孤电子 |
| C.N2分子中N原子没有杂化,分子中有1个σ键、2个π键 |
| D.H2SO4分子中三种原子均以杂化轨道成键 |