常温时,下列各组离子在指定溶液中能大量共存的是
| A.pH = 1的溶液中: Fe2+、NO3-、SO42-、Na+ |
| B.c(Fe3+) =" 0.1" mol/L的溶液中:K+、ClO-、SO42-、SCN- |
| C.c(H+)/c(OH-) = 1012的溶液中: NH4+、Al3+、NO3-、Cl- |
| D.由水电离的c(H+) = 1×10-14 mol/L的溶液中:Ca2+、K+、Cl-、HCO3- |
对剧毒的氰化物可在碱性条件下用如下方法进行处理:
2CN- +8OH-+5Cl2= 2CO2 +N2 +10Cl- +4H2O 下列判断正确的是
| A.当有0.2 mol CO2生成时,溶液中阴离子的物质的量增加1mol |
| B.该反应中,每有2molCN-反应,转移电子为10mol |
| C.上述反应中的还原剂是OH- |
| D.还原性:Cl-> CN- |
下列有关实验操作正确的是
| A.用过滤法分离氢氧化铁胶体和三氯化铁溶液的混合物 |
| B.用容量瓶配制溶液,定容后摇匀液面下降,再加蒸馏水至刻度线配制溶液浓度 |
| C.向含有少量Ca(OH)2的Mg(OH)2悬浊液中加入饱和MgCl2溶液,充分搅拌后过滤,洗涤,可达到除去Mg(OH)2中的少量Ca(OH)2的目的 |
| D.将金属钠投入到足量CuSO4溶液中,静置后溶液质量增加 |
用于制取、并收集表格中的四种气体(a、b、c表示相应仪器中加入的试剂)其中可行的是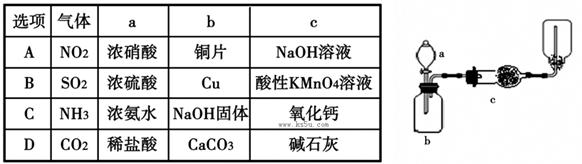
短周期元素X、Y、Z、W在元素周期表中的相对位置如右图所示,其中X所处的周期序数与族序数相等。下列说法错误的是
| A.Z的氧化物与W的氧化物的化学键类型相同 |
| B.X、Z的氧化物都能溶于氢氧化钠和稀硫酸溶液中 |
| C.最高价氧化物对应水化物稀溶液的氧化性:W<Z |
| D.Y原子的半径比W原子的半径大 |
下列根据实验操作和现象所得出的结论正确的是:
| 选项 |
实验操作 |
实验现象 |
结论 |
| A |
洁净的铁钉在浓硝酸中浸泡片刻,蒸馏水冲洗后,再放入CuSO4溶液 |
铁钉表面无红色物质生成 |
铁钉在浓硝酸中已钝化 |
| B |
向溶液X中先滴加稀NaOH溶液,再将湿润红色石蕊试纸置于试管口附近 |
试纸不变蓝 |
原溶液X中肯定无NH4+ |
| C |
向PbO2中滴入浓盐酸 |
有黄绿色气体 |
PbO2具有还原性 |
| D |
向溶液X 中先滴加氯水,再滴加KSCN溶液 |
溶液变红 |
溶液X中一定含有Fe2+ |