氧化还原反应与四种基本类型反应的关系如下图所示,则下列化学反应属于区域3的是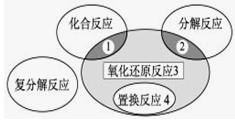
A.2H2+O2 点燃 2H2O
B .2NaHCO3
.2NaHCO3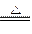 Na2CO3+H2O +CO2↑
Na2CO3+H2O +CO2↑
C.Zn +H2SO4 = ZnSO4 + H2↑
D.CuO+CO 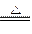 Cu + CO2
Cu + CO2
将4 mol A和2 mol B放入2 L密闭容器中发生反应2A(g) + B(g)  2C(g) ΔH<0。4 s后反应达到平衡状态,此时测得C的浓度为0.6 mol/L。下列说法正确的是
2C(g) ΔH<0。4 s后反应达到平衡状态,此时测得C的浓度为0.6 mol/L。下列说法正确的是
A.4 s内,υ(B)=0.075 mol/(L ·s)
B.当c(A)︰c(B)︰c(C)=2︰1︰2 时,该反应即达到平衡状态
C.达到平衡状态后,若只升高温度,则C的物质的量浓度增大
D.达到平衡状态后,若温度不变,缩小容器的体积,则A的转化率降低
现有三组混合液:①乙酸乙酯和乙酸钠溶液,②乙醇和丁醇,③溴化钠和单质溴的水溶液,分离以上各混合液的正确方法依次是
| A.分液、萃取、蒸馏 | B.分液、蒸馏、萃取 |
| C.萃取、蒸馏、分液 | D.蒸馏、萃取、分液 |
下列各元素中,一定属于主族元素的是
| A.X元素能形成+7价的含氧酸及其盐 |
| B.Y元素原子最外层电子数为2 |
| C.Z元素的阴离子与同一周期稀有气体元素的原子电子层结构相同 |
| D.R元素的最高价氧化物是酸性氧化物 |
设阿伏加德罗常数为NA,下列说法正确的是
| A.1molCnH2n+2烃分子中,含有碳碳键数目为n NA |
B.一定条件下,密闭容器中加入2molSO2、1molO2发生反应2SO2+O2 2SO3,转移的电子数目为4NA 2SO3,转移的电子数目为4NA |
| C.53g碳酸钠固体中,碳酸根离子的数目为0.5 NA |
| D.2g重氧水(H218O)中的中子数为0.8 NA |
在一密闭容器中充入一种气态烃和足量的氧气,用电火花点燃完全燃烧后,容器内气体体积保持不变,若气体体积均在120℃和相同的压强下测定的,这种气态烃是
| A.CH4 | B.C2H6 | C.C2H2 | D.C3H6 |