(12分)某探究学习小组的同学学习氨的性质以后,为了探究氨气的某些性质,设计并进行了以下实验:
(Ⅰ)NH3的制取及收集
1.写出实验制取氨气的化学方程式 ;
2.收集氨气的方法是 。
(II)HCl的制取及收集
实验室通常以反应:2NaCl(晶体)+H2SO4(浓)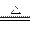 Na2SO4 + 2HCl↑ 为原理来制取少量HCl气体,试据此分析并回答下列问题:
Na2SO4 + 2HCl↑ 为原理来制取少量HCl气体,试据此分析并回答下列问题:
1.实验室制取HCl气体可选择下列装置中的
| A.实验室制氧气的装置 | B.实验室制氢气的装置 |
| C.实验室制二氧化碳的装置 | D.实验室制氯气的装置 |
(III)验证氨气部分性质的探究实验:
为了同时进行氨气溶于水以及氨气与HCl的反应的探究,同学们积极思考并设计了如下的实验装置图。首先在甲、乙两个干燥的圆底烧瓶中分别收集满了NH3和HCl气体,然后再按如下图所示连接好各个装置(活塞a和b均处于关闭状态),并按以下步骤进行实验: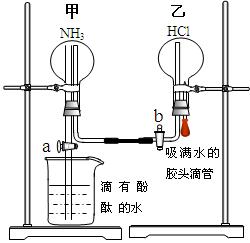
1.先挤压胶头滴管再打开活塞b,请你预测此时乙中可能观察到的现象是:  。
。
发生反应的方程式为: 。
2.待乙中观察到明显现象后立 即关闭活塞b,并打开活塞a,又将可能观察到的实验现象是: 。
即关闭活塞b,并打开活塞a,又将可能观察到的实验现象是: 。
工业生产的纯碱中常含有少量NaCl杂质。为测定某纯碱样品的纯度,化学课外活动小组设计了两种实验方案:
【方案一】取样品溶解后,加试剂使CO32-沉淀,测定沉淀的质量。
【方案二】用稀酸将CO32-转化为CO2,测定CO2的质量。
(1)方案一的操作步骤有:①称量样品W1 g并溶解样品;②加入足量的BaCl2溶液;③过滤;④洗涤;⑤干燥;⑥称量沉淀W2 g并进行恒重操作,最后称量沉淀W3 g。
称量时所需定量实验仪器为__________。判断是否达到恒重的标准是___________。根据方案一的数据,算出样品中纯碱的质量分数为__________________(用代数式表示)。
(2)方案二的实验装置如下图: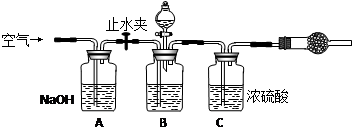
操作步骤有:①检查装置的气密性;②在干燥管内装满碱石灰,称量质量为W1 g;③称量W2 g样品装入广口瓶B中;④缓缓鼓入空气数分钟;⑤关闭止水夹,缓慢加入稀H2SO4至不再产生气体为止;⑥打开止水夹;⑦缓缓鼓入空气数分钟,再称量干燥管,质量为W3 g。
根据方案二的数据,算出样品中纯碱的质量分数为__________________(用代数式表示)。
上图中装置A的作用是_____________________。装置C的作用是___________________。如果没有装置A和实验操作④⑦,会导致测量结果______________(填“偏大”、“偏小”或“无影响”)。有同学认为空气中的水蒸气会进入干燥管导致测量结果__________(填“偏大”、“偏小”或“无影响”),改进措施可以是________________________。
喷泉是一种常见的自然现象,其产生的原因是存在压强差。制取氨气并完成喷泉实验(图中夹持装置均已略去)。 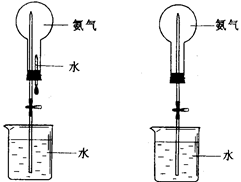

(1)写出实验室制取氨气的化学方程式:。
(2)收集氨气应使用法。
(3)要得到干燥的氨气可选用下列 做干燥剂。
| A.浓硫酸 | B.碱石灰 | C.NaOH固体 | D.P2O5固体 |
(4)用图1装置进行喷泉实验,烧瓶已装满干燥氨气,引发水上
喷的操作是。该实验的原理是。
(5)如果只提供如图2的装置,请举例说明引发喷泉法。
某研究性学习小组利用手持技术探究强碱和不同的酸中和反应的过程如下:
(1)实验步骤:
① 分别配制浓度均为0.1mol·L-1的NaOH、HC1、CH3 COOH、H3PO4溶液备用。配制过程中用到的玻璃仪器有烧杯、容量瓶、玻璃棒、细口瓶、、。
② 在锥形瓶中加入10mL0.1 mol·L-1的HC1,在25.00mL(填“酸式”、“碱式”)滴定管中加入0.1 mol·L-1的NaOH,连接数据采集器和pH传感器。
③ 向锥形瓶中滴入NaOH,接近估算的NaOH用量附近时,减慢滴加速度,等读数稳定后,再滴下一滴NaOH。
④存储计算机绘制的pH变化图。用0.1 mol·L-1的CH3 COOH、H3 PO4溶液代替HC1重复上述②~④的操作。
(2)结果分析:20℃时NaOH分别滴定HC1、CH3 COOH、H3 PO4的pH变化曲线如下。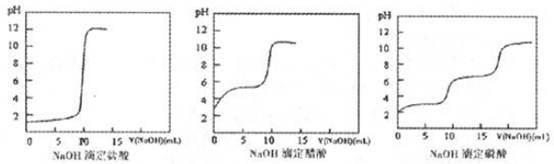
根据上述曲线回答下列问题:
①20℃时,三种酸从强到弱的顺序是;
②滴定开始后醋酸曲线变化比盐酸快的原因是;
③醋酸恰好中和时pH≈8的原因是;
④某同学认为前述的步骤中,NaOH滴定磷酸不可行其原因是 。
分子筛是一种具有立方晶格的硅铝酸盐化合物。分子筛具有均匀的微孔结构,它的孔穴直径大小均匀,这些孔穴能把比其直径小的分子吸附到孔腔的内部,并对极性分子和不饱和分子具有优先吸附能力,因而能把极性程度不同,饱和程度不同,分子大小不同及沸点不同的分子分离开来,即具有“筛分”分子的作用,故称分子筛。由于分子筛具有吸附能力高,热稳定性强等其它吸附剂所没有的优点,使得分子筛获得广泛的应用。某种型号的分子筛的工业生产流程可简单表示如下: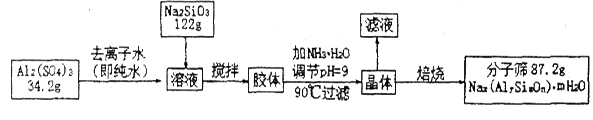
在加NH3• H2O调节pH的过程中,若pH控制不当会有Al(OH)3生成,假设生产流程中铝元素和硅元素均没有损耗,钠原子的利用率为10℅。
(1)分子筛的孔道直径为 称为4A型分子筛,当Na+被Ca2+取代时就制得5A型分子筛,当Na+被K+取代时就制得3A型分子筛。要高效分离正丁烷(分子直径为4.65
称为4A型分子筛,当Na+被Ca2+取代时就制得5A型分子筛,当Na+被K+取代时就制得3A型分子筛。要高效分离正丁烷(分子直径为4.65 )和异丁烷(分子直径为5.6
)和异丁烷(分子直径为5.6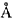 )应该选用型分子筛。
)应该选用型分子筛。
(2)Al2(SO4)3溶液与Na2SiO3溶液反应生成胶体的离子方程式为。
(3)该生产流程中所得滤液里含有的离子除H+、OH-外,主要为。
(4)加NH3·H2O调节pH后,加热到900C并趁热过滤的原因可能是。
(5)该生产流程中所得分子筛的化学式为。
长郡中学某化学兴趣小组设计如图所示的实验装置来探究隔绝空气加热后亚硫酸钠分解后的产物(查阅资料:无水亚硫酸钠隔绝空气受热到600℃才开始分解)。
(1)如何检查上述装置的气密性____________________________________________________。
(2)如果加热温度低于600℃,向所得冷却后固体试样中滴加70%硫酸至足量,在装置B中观察到的现象为_______________________________________________________________,此时A中反应的离子方程式为:______________________________________________。
(3)当加热温度为600℃以上一会儿后,向所得冷却后固体试样中缓缓滴加稀盐酸至足量,观察到烧瓶中出现淡黄色沉淀,同时发现在B中无明显现象,C中发现有黑色沉淀产生,则生成淡黄色沉淀的离子方程式为_________________________________________________。
(4)在(3)中滴加足量稀盐酸后,烧瓶内除Cl-外,还存在另一种浓度较大的阴离子。请简述检验该离子的方法:____________________________________________________________。
(5)写出Na2SO3固体加热到600℃以上分解的化学方程式:_________________________。