下列晶体熔化时,晶体中的化学键未被破坏的是
| A.金属镁 | B.氯化钠晶体 | C.冰 | D. 晶体硅 晶体硅 |
石墨晶体是层状结构,在每一层内;每一个碳原子都跟其他3个碳原子相结合,如图是其晶体结构的俯视图,则如图中7个六元环完全占有的碳原子数是
| A.10个 | B.14个 | C.18个 | D.21个 |
下列关于杂化轨道的叙述中,不正确的是
| A.杂化轨道可用于形成σ键、π键或用于容纳未参与成键的孤电子对 |
| B.分子中中心原子通过sp3杂化轨道成键时,该分子不一定为正四面体结构 |
| C.杂化前后的轨道数不变,但轨道的形状发生了改变 |
| D.sp3、sp2、sp杂化轨道的夹角分别为109°28′、120°、180° |
以下有关元素性质的说法不正确的是
| A.具有下列电子排布式的原子中,①1s22s22p63s23p2②1s22s22p3③1s22s22p2④1s22s22p63s23p4原子半径最大的是① |
| B.具有下列价电子排布式的原子中,①3s23p1②3s23p2③3s23p3④3s23p4,第一电离能最大的是③ |
| C.①Na、K、Rb ②O、S、Se ③Na、P、Cl,元素的电负性随原子序数增大而递增的是③ |
| D.某元素气态基态原子的逐级电离能分别为738、1451、7733、10540、13630、17995、21703,当它与氯气反应时可能生成的阳离子是X3+ |
下列叙述中,正确的是
| A.在一个基态多电子的原子中,可以有两个运动状态完全相同的电子 |
| B.在一个基态多电子的原子中,不可能有两个能量完全相同的电子 |
| C.在一个基态多电子的原子中,M层上的电子能量肯定比L层上的电子能量高 |
D.某基态原子错误的核外电子排布图为 该排布图违背了泡利原理 该排布图违背了泡利原理 |
下列有关化学用语正确的是
| A.26Fe的价层电子排布式为3d64s2 |
| B.35Br的电子排布式可简写为[Ar]4s24p5 |
C.NH4Cl的电子式为 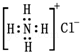 |
D.氯离子结构示意图为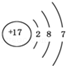 |