某密闭容器中充入等物质的量的气体A和B,一定温度下发生反应A(g)+xB(g) 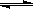 2C(g),达到平衡后,只改变反应的一个条件,测得容器中物质的浓度、反应速率随时间变化的如下图所示。下列说法中正确是
2C(g),达到平衡后,只改变反应的一个条件,测得容器中物质的浓度、反应速率随时间变化的如下图所示。下列说法中正确是
| A.30min时降低温度,40min时升高温度 |
| B.8min前A的平均反应速率为0.08mol/(L·min) |
| C.反应方程式中的x=1,正反应为吸热反应 |
| D.20min~40min间该反应的平衡移动了 |
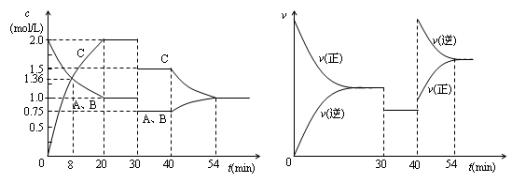
能正确表示下列化学反应的离子方程式的是
| A.金属钾投入水中K + H2O = K+ + OH—+ H2↑ |
| B.亚硝酸钠与FeCl2溶液反应 NO2 + Fe2+ +2H+ =" NO↑" + Fe3+ + H2O |
| C.用盐酸检验牙膏中的碳酸钙CO32—+ 2H+ = CO2↑+ H2O |
D.电解饱和食盐水 Cl—+ H2O H2 ↑+ Cl2↑+ OH— H2 ↑+ Cl2↑+ OH— |
下列叙述中,正确的是
| A.含金属元素的离子不一定都是阳离子 |
| B.在氧化还原反应中,非金属单质一定是氧化剂 |
| C.某元素从化合态变为游离态时,该元素一定被还原 |
| D.金属阳离子被还原不一定得到金属单质 |
下列分子中所有原子都满足最外层为8电子结构的是
| A.BF3 | B.H2O | C.SiCl4 | D.PCl5 |
下列各组物质中,常温下能起反应产生气体的是:
| A.铁跟浓硫酸 | B.铜跟浓硝酸 | C.铜跟浓硫酸 | D.铝跟浓硝酸 |
为迎“绿色世博,低碳世博”,某同学提出了下列环保建议,其中你认为可以采纳的是
①提高汽车尾气排放标准②使用无汞电池
③使用可降解塑料袋,减少白色污染④分类回收垃圾
⑤使用无磷洗涤剂;⑥提倡使用手帕,减少餐巾纸的使用
| A.①②③④ | B.②③④⑤ | C.①②④⑤⑥ | D.全部 |