下列说法不正确的是
| A.任何状况下的18gH2O和22gCO2所含的氧原子数相同 |
| B.标准状况下,0.5mol H2和0.5mol N2组成的混合气体的体积约为22.4L |
| C.氢氧化钠的摩尔质量为40g |
| D.同温同压下,1 L O2与1 L O3具有相同的分子数(二者均为气体) |
下列各组物质最简式相同,但既不是同系物,又不是同分异构体的是
A.CH3CH===CH2和
B.乙炔和苯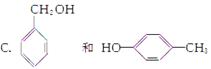
D.乙酸和甲酸甲酯
下列说法中正确的是
| A.分子组成相差1个或若干个CH2原子团的物质互称为同系物 |
| B.相对分子质量相同的有机物是同分异构体 |
| C.碳原子之间只以单键相结合的链烃为烷烃 |
| D.分子式相同的有机物一定是同一种物质 |
1H核磁共振谱是指有机物分子中的氢原子核所处的化学环境(即其附近的基团)不同,表现出的核磁性就不同,代表核磁性特征的峰在核磁共振图中坐标的位置(化学位移,符号为δ)也就不同。现有一物质的1H核磁共振谱如图所示: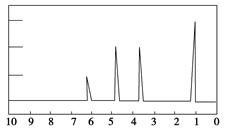
则该物质可能是下列中的
| A.CH3CH2CH3 | B.CH3CH2CH2OH | C.CH3CH2CH2CH3 | D.CH3CH2OH |
下列关于著名化学家的名字、国籍及主要贡献的对应关系中,不正确的是
| 科学家 |
国籍 |
主要贡献 |
|
| A |
贝采利乌斯 |
瑞典 |
首先提出“有机化学”和“有机化合物”的概念 |
| B |
维勒 |
德国 |
首次人工合成了有机物——尿素 |
| C |
李比希 |
法国 |
创立了有机物的定量分析方法 |
| D |
门捷列夫 |
俄国 |
发现元素周期律 |
下图是可逆反应3X2 + Y2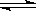 2Z2在反应过程中的反应速率(V)与时间(t)的关系曲线,下列叙述正确的是
2Z2在反应过程中的反应速率(V)与时间(t)的关系曲线,下列叙述正确的是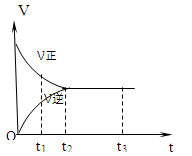
| A.t1时,只有正方向反应没有逆方向反应 |
| B.t2时,反应已达到平衡状态 |
| C.t2- t3,各物质的浓度不再发生变化 |
| D.t2- t3,处于静止状态,反应不再发生 |