H(g)+H(g) = H2(g) ;△H = -435.7KJ/mol,这个式子说明的意义是
A. 氢原子的能量比氢分子的能量低 氢原子的能量比氢分子的能量低 |
| B.一个氢原子与一个氢原子结合生成1个氢分子,且放出435.7KJ的能量 |
| C.1mol氢分子分解成2mol氢原子要吸收435.7KJ能量 |
| D.2mol氢原子结合成1mol氢分子要吸收435.7KJ能量 |
已知氯乙烷跟氢氧化钠醇溶液共热可得乙烯,现由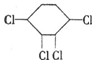 制取
制取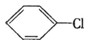 其中所涉及加成反应和消去反应的次数为 ( )
其中所涉及加成反应和消去反应的次数为 ( )
| A.2,2 | B.3,3 | C.2,3 | D.3,2 |
下列在一定条件下进行的反应属于水解反应的是()
①C12H22O11(麦芽糖)+ H2O → 2C6H12O6②CH2=CH2 + H2O → CH3CH2OH
③ CH3CH2Cl + H2O → CH3CH2OH + HCl④NH3·H2O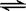 NH4+ + OH-
NH4+ + OH-
⑤ CH3CH2ONa + H2O → CH3CH2OH + NaOH⑥CaC2 + 2H2O → Ca(OH)2 + C2H2↑
| A.②④ | B.①②⑤ | C.③④⑥ | D.①③⑤⑥ |
现有一系列稠环芳香烃,按如图特点排列: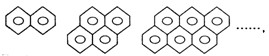
若用通式表示这一系列化合物,其通式为( )
A.CnH2n-6 B.C4n-6H2n+6C.C2n+4H6n+6D.C6n+4H2n+6
现有一蛋白质分子由2条多肽链组成,共有肽键98个。已知构成这种蛋白质的氨基酸的平均分子量为128,则此蛋白质的平均相对分子质量最接近于()
| A.12800 | B.11036 | C.12544 | D.12288 |
下列物质中属于酯类的是()
| A.石蜡油 | B.甘油 | C.酚醛树脂 | D.花生油 |