一种燃料电池中发生的化学反应为:在酸性溶液中甲醇与氧作用生成水和二氧化碳。该电池负极发生的反应是
| A.CH3OH(g)+O2(g)=H2O(1)+CO2(g)+2H+(aq)+2e- |
| B.O2(g)+4H+(aq)+4e-=2H2O(1) |
| C.CH3OH(g)+H2O(1)=CO2(g)+6H+(aq)+6e- |
| D.O2(g)+2H2O(1)+4e-=4OH- |
下列药品对应的临床应用错误的是
| A.服用过量的阿司匹林中毒后应立即停药,并静脉注射NaHCO3 |
| B.青霉素的不良反应是过敏反应,因此用药前要进行皮肤敏感试验 |
| C.麻黄碱适合于医治因葡萄球菌和链球菌等引起的血毒症 |
| D.服用麻黄碱的不良反应是有时出现由于中枢神经兴奋所导致的不安、失眠等 |
阿司匹林结构式为根据其结构推断,其不可能有的性质为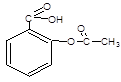
| A.与NaOH溶液反应 | B.与金属钠反应 |
| C.与乙酸发生酯化反应 | D.与乙醇发生酯化反应 |
某人胃酸过多,他应该用下列哪种药品治疗
| A.阿司匹林 | B.青霉素 | C.麻黄碱 | D.胃舒平 |
某些高温油炸食品含有丙烯酰胺。过量的丙烯酰胺可引起食品安全问题。关于丙烯酰胺叙述不正确的是
| A.能使酸性KMnO4溶液褪色 | B.能发生加聚反应 |
| C.能与乙醇发生酯化反应 | D.能与氢气发生加成反应 |
下列食品添加剂与类别对应正确的一组是
| A.着色剂——胡萝卜素、苯甲酸钠 |
| B.调味剂——亚硝酸钠、味精 |
| C.防腐剂——日落黄、山梨酸钾 |
| D.营养强化剂——酱油中加铁、粮食制品中加赖氨酸 |