一定条件下,CH3COONa溶液存在水解平衡:CH3COO-+H2O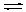 CH3COOH+OH-,下列说法正确的是
CH3COOH+OH-,下列说法正确的是
| A.加入少量NaOH固体,c(CH3COO-)增大 |
| B.加入少量FeCl3固体,c(CH3COO-)减小 |
| C.稀释溶液,溶液的pH增大 |
| D.加入适量醋酸得到的酸性混合溶液:c (Na+)>c(CH3COO-)>c(H+)>c(OH-) |
将镁、铝合金10.2 g溶于 4 mol·L-1的盐酸500 mL 里,若加入 2 mol·L-1的氢氧化钠溶液,并使得沉淀达到最大量,则需加入此种氢氧化钠溶液为()
| A.1000 mL | B.500 mL | C.100 mL | D.1500 mL |
无色的混合气体甲中可能含NO、CO2、NO2、NH3、N2中的几种。将100 mL气体甲经过下图实验处理,结果得到酸性溶液,而几乎无气体剩余,则气体甲的组成可能为( )
| A.NH3、NO2、N2 | B.NH3、NO、CO2 |
| C.NH3、NO2、CO2 | D.NO、CO2、N2 |
在10L密闭容器中,A、B、C三种气态物质构成了可逆反应的体系;当在某一温度时,A、B、C物质的量与时间的关系如图一,C的百分含量与温度的关系如图二。
下列分析不正确的是:()
A.0~4分钟时,A的速率为0.01mol/(L•min) B.由T1向T2变化时,V正> V逆
C.该反应的平衡常数表达式K= D.此反应的正反应为吸热反应.
D.此反应的正反应为吸热反应.
已知W、X、Y、Z为短周期元素,W、Z同主族,X、Y、Z同周期, W气态氢化物的稳定性大于Z的气态氢化物的稳定性,X、Y为金属元素,X的阳离子的氧化性小于Y的阳离子的氧化性。下列说法正确的是()
| A.XYZW的原子半径依次减小 |
| B.W与X形成的化合物中只含离子键 |
| C.W的气态氢化物的沸点一定高于Z的气态氢化物的沸点 |
| D.若W与Y的原子序数相差5,则二者形成化合物的化学式一定为Y2W3 |
向一定量的Fe、FeO和Fe2O3的混合物中加入240 mL4 mol·L-1的稀硝酸,恰好使混合物完全溶解,放出2.688L NO(标准状况),往所得溶液中加入KSCN溶液,无红色出现。若用足量的氢气还原相同质量的混合物,能得到铁的物质的量()
| A.0.48 mol | B.0.42mol | C.0.32 mol | D.0.28 mol |