把VL含有MgSO4和Al2(SO4)3的混合溶液分成两等份,一份加入含a mol NaOH的溶液,恰好使铝离子完全转化为[Al(OH)4]-;另一份加入含b mol BaCl2的溶液,恰好使硫酸根离子完全沉淀为BaSO4。则原混合溶液中Mg2+的浓度为
A.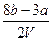 mol·L-1 mol·L-1 |
B.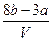 mol·L-1 mol·L-1 |
C.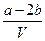 mol·L-1 mol·L-1 |
D.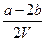 mol·L-1 mol·L-1 |
下列判断中一定正确的是
| A.若R2-和M+的电子层结构相同,则原子序数:M > R |
| B.若X、Y是同主族气态氢化物,且相对分子质量:X>Y,则沸点:X>Y |
| C.若M、N是同主族非金属元素,且电子层数:M>N,则非金属性:M>N |
| D.若X、Y属于同周期元素,且原子序数:X>Y,则最高正价:X>Y |
中科院化学所研制的晶体材料——纳米四氧化三铁,在核磁共振造影及医药上有广泛用途.将四氧化三铁放入稀HNO3中可发生如下反应:3Fe3O4+28HNO3=9Fe(NO3)x+NO↑+14H2O,下列判断合理的是
| A.Fe(NO3)x中的x为2 |
| B.磁性氧化铁中的铁元素全部被氧化 |
| C.纳米四氧化三铁可分散在水中,它与FeCl3溶液的分散质直径相当 |
| D.反应中每生成0.4 mol还原产物,就有1.2 mol电子转移 |
下列有关热化学方程式书写及对应表述均正确的是
| A.密闭容器中,9.6g硫粉与11.2g铁粉混合加热生成硫化亚铁17.6 g时,放出19.12 kJ热量。则Fe(s)+S(s)=FeS(s)△H=-95.6kJ/mol |
| B.稀醋酸与0.1 mol/LNaOH溶液反应:H+(aq)+OH-(aq)=H2O(l)△H=-57.3kJ/mol |
| C.已知1 mol氢气完全燃烧生成液态水所放出的热量为285.5 kJ,则水分解的热化学方程式:2H2O(l)=2H2(g)+O2(g)△H=+285.5kJ/mol |
| D.已知2C(s)+O2 (g)=2CO(g)△H=-221kJ/mol,则可知C的燃烧热△H=-110.5kJ/ mol |
下列物质的制备与工业生产相符的是
①NH3 NO
NO HNO3
HNO3
②浓HCl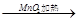 Cl2
Cl2 漂白粉
漂白粉
③MgCl2(aq) 无水MgCl2
无水MgCl2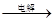 Mg
Mg
④饱和NaCl(aq) NaHCO3
NaHCO3 Na2CO3
Na2CO3
⑤铝土矿 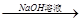 NaAlO2溶液
NaAlO2溶液 Al(OH)3
Al(OH)3 Al2O3
Al2O3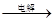 Al
Al
| A.①④⑤ | B.①③⑤ | C.②③④ | D.②④⑤ |
下列表示对应化学反应的离子方程式正确的是
A.Na2CO3溶液的水解:CO32—+H3O+ HCO3—+H2O HCO3—+H2O |
| B.AlCl3溶液中滴加浓氨水至过量:Al3++4NH3·H2O=AlO2—+4NH4++2H2O |
| C.氯化亚铁溶液中加入硝酸:3Fe2++4H++NO3-=3Fe3++2H2O+NO↑ |
| D.向NaHSO4溶液中加入过量Ba(OH)2溶液:Ba2++2OH-+2H++SO42-= BaSO4↓+2H2O |