如图装置(I)为一种可充电电池的示意图,其中的离子交换膜只允许K+通过,该电池放电、充电的化学方程式为:2K2S2+KI3 K2S4+3KI。装置(II)为电解池的示意图。当闭合开关K时,电极X附近溶液先变红。则闭合K时,下列说法正确的是( )
K2S4+3KI。装置(II)为电解池的示意图。当闭合开关K时,电极X附近溶液先变红。则闭合K时,下列说法正确的是( )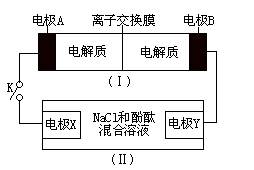
| A.K+从右到左通过离子交换膜 |
| B.电极A上发生的反应为:3I--2e-=I3- |
| C.电极X上发生的反应为:2Cl--2e-=C12↑ |
| D.当有0.1molK+通过离子交换膜,X电极上产生1.12L气体(标准状况) |
苯甲酸和山梨酸CH3CH=CH-CH=CH-COOH都是常用的食品防腐剂,下列物质中只能与其中的一种酸发生反应的是()
| A.溴水 | B.金属钾 | C.氢氧化钠 | D.甲醇 |
某烃的一种同分异构体只能生成一种一氯化物,该烃的分子式可能是()
| A.C3H8 | B.C4H10 | C.C5H12 | D.C6H14 |
某有机物的结构简式为CH2=CHCHCHO,下列对其化学性质的判断
中,不正确的是() CH3
CH3
| A.能被银氨溶液氧化 | B.1 mol该有机物只能与1mol Br2发生加成反应 |
| C.能使KmnO4酸性溶液褪色 | D.1 mol该有机物只能与1mol H2发生加成反应 |
已知C6H5ONa+CO2+H2O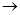 C6H5OH+NaHCO3,某有机物的结构式如右:
C6H5OH+NaHCO3,某有机物的结构式如右:
Na,NaOH,NaHCO3分别与等物质的量的该物质恰好反应时,Na,NaOH,NaHCO3的物质的量之比为()
| A.3:3:2 | B.3:2:1 | C.1:1:1 | D.3:2:2 |
下列化合物中,既能发生消去反应,又能发生水解反应的是()
| A.氯仿 | B.一氯甲烷 | C.乙醇 | D.一氯乙烷 |