下列离子方程式书写正确的是
A.实验室用氯化铵和熟石灰制氨:NH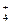 + OH- + OH-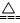 NH3↑+H2O NH3↑+H2O |
B.NaOH与NH4Cl溶液混合加热:NH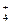 + OH- + OH- NH3·H2O NH3·H2O |
C.氨水中加盐酸:NH3·H2O+H+="=" NH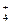 +H2O +H2O |
D.氨水中通入少量CO2:CO2+2NH3·H2O="==" 2NH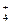 +CO +CO + H2O + H2O |
右图为周期表中短周期的一部分,若a原子最外层电子数比次外层电子数少3个,下说法中不正确的是()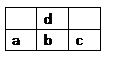
| A.原子半径大小顺序是c>b>d>a |
| B.d的氢化物比a的氢化物稳定 |
| C.a和d的原子结合可以形成带3个负电荷的阴离子 |
| D.a、b、c最高价氧化物对应水化物的酸性强弱关系是c>b>a |
已知元素的原子序数,可以推断原子的()
①质子数;②中子数;③最外层电子数;
④核电荷数;⑤核外电子总数;⑥相对原子质量
| A.①③④⑤ | B.①②④⑤ | C.①④⑤⑥ | D.①②③⑤ |
图为元素周期表的一部分(数字为原子序数),其中X元素的原子序数为35的是()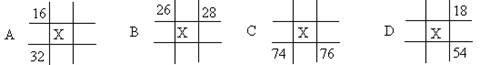
某有机物在氧气中充分燃烧,只生成水蒸气和二氧化碳,且两者物质的量之比为1:1,由此可以得出的结论是()
A.可以推算出该有机物的化学式 B.分子中C、H原子个数之比为1:2
C.分子中C、H原子个数之比为1:1 D.分子中必定含氧原子
下列关于周期表中元素分界线的叙述中正确的是()
| A.通常用来制农药的元素,在分界线附近 |
| B.制半导体材料的元素,位于分界线的左下方 |
| C.分界线两侧的元素中,可用作催化剂或制耐高温材料 |
| D.周期表中分界线,把表中元素分成金属和非金属两个区域 |