下图是中学教材中元素周期表的一部分,其 中标出A~Q14种元素,试回答下列问题:
中标出A~Q14种元素,试回答下列问题:
|
|
|
|
|
|
|
|
|
|
|
|
|
|

已知某待测液由Ag+、Mg2+、K+、Ba2+、NH4+、NO3-中的若干种离子组成,进行如下实验:
第一步:加入过量的稀盐酸,有白色沉淀生成。
第二步:过滤,在滤液中加入过量的稀硫酸,又有白色沉淀生成。
第三步:再过滤,取少量滤液,滴入NaOH 溶液至溶液呈碱性,在此过程中溶液无明显现象,加热该溶液,可产生使湿润的红色石蕊试纸变蓝色的气体。
溶液至溶液呈碱性,在此过程中溶液无明显现象,加热该溶液,可产生使湿润的红色石蕊试纸变蓝色的气体。
根据实验现象回答:
(1)分别写出第二步和第三步中所涉及的反应的离子方程式:
第二步: ,
第三步: ;
(2)待测液中一定含有、NO3-离子,一定不含有离子,还有一种离子不能确定其是否存在,要检验这种离子的实验方法是(填写实验名称和观察到的现象及结论,不要求写实验操作过程),。
现有常见金属单质A和气体甲、乙及物质B、C、D、E、F,它们之间能发生如下反应,已知B加入硫氰化钾溶液显血红色,气体乙显红棕色,(图中有些反应的产物和反应的条件没有全部标出)。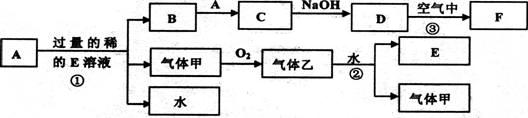
请根据以上信息回答下列问题:
(1)写出下列物质的化 学式:A ,C
学式:A ,C
(2)写出反应①的化学方程式;
(3)写出反应②的化学方程式;
(4)B物质的阳离子用于制作印刷电路板的原理是(用离子方程式表示)
(5)缺铁性贫血患者应补充C物质的阳离子,而B物质的阳离子则无这种药效。当用C物质的阳离子制成药片时外表包有一层特殊的糖衣,这层糖衣的作用是
如果药片已经失效,应如何检验?写出主要操作与现象:。
含硫化合物的种类很多,现有H2SO4、H2SO3、SO2、Na2SO3、BaSO4、CuSO4、Na2SO4这7种常见的含硫化合物。回答下列问题:
(1)H2SO3转化为硫酸是酸雨形成的重要过程之一,写出其反应的化学方程式,并标明电子转移方向和数目:。
(2)Ba2+有剧毒。某市曾发生一起“毒烧饼”事件,起因是烧饼摊主在制作烧饼的过程中误将碳酸钡当作干粉使用,导致多人食用烧饼后中毒。试写出碳酸钡与胃酸(以盐酸表示)反应的离子反应方程式。
(3)常温下,将铁棒置于浓硫酸中,无明显现象,课本 上解释为发生了钝化,但有人认为未发生反应。为验证此过程,某同学经过思考,设计了如下实
上解释为发生了钝化,但有人认为未发生反应。为验证此过程,某同学经过思考,设计了如下实 验:将经浓硫酸处理过的铁棒洗净后置于CuSO4溶液中,若铁棒表面,则发生了钝化;若铁棒表面,则未发生反应。
验:将经浓硫酸处理过的铁棒洗净后置于CuSO4溶液中,若铁棒表面,则发生了钝化;若铁棒表面,则未发生反应。
(4)用Na2SO3吸收法作为治理SO2污染的一种方法,其原理为(用化学方程式表示):。
(5)减少SO2的污染并变废为宝,我国正在探索在一定条件下用CO还原SO2得到单质硫的方法来除去SO2。该反应的化学方程式: 。
(6)制取硫酸铜有两种方法:方法一:2Cu+O2  2CuO,CuO+ H2SO4= CuSO4+H2O,
2CuO,CuO+ H2SO4= CuSO4+H2O,
方法二:Cu+ 2H2SO4(浓)
2H2SO4(浓) CuSO4+SO2↑+2H2O,方法一与方法二相比,其优点是:
CuSO4+SO2↑+2H2O,方法一与方法二相比,其优点是:
(答任一点)。
分析、归纳、探究是学习化学的重要方法和手段之一.下面就电解质A回答有关问题(假定以下都是室温时的溶液)。
(1)电解质A的化学式为NanB,测得浓度为c mol/L的A溶液的pH=a
①当a=10时,A溶液呈碱性的原因是(用离子方式程式表示)。
②当a=10,n=1时,A溶液中各种离子浓度由大到小的顺序为,
c(OH-)-c(HB)=________ mol/L。
③当n=1、c=0.1、溶液中c(HB)∶c(B-)=1∶99时,A溶液的pH为______(保留整数值)。
(2)已知难溶电解质A的化学式为XnYm,相对分子质量为M,测得其饱和溶液的密度为ρ g/cm3,Xm+离子的浓度为c mol/L,则该难溶物XnYm的溶度积常数为Ksp=_____________,该温度下XnYm的溶解度S=____________g
(8分) 已知A为蓝色溶液,B、C、I、K为单质,其余均为化合物,其中B、L、I、K 常温下为气体,且只有I为有色气体。G为黑色固体,F的焰色反应透过蓝色钻玻璃片显紫色,各物质转化关系如图。
回答下列问题:
(1)F的电子式:____________;
(2)写出反应①的化学反应方程式:;
(3)用惰性电极电解足量A溶液,一段时间后,若要使溶液恢复到电解前的状态,则可向溶液中加入适量___________或__________。
(4)已知B、H和C2H5OH能够组成燃料电池,写出该燃料电池的负极电极反应方程式:;